Mouvement
d'un palet ; laser, autour de l'azote, acide phosphorique.
Concours TSPEI 2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice
1 : mouvement d'un palet sur
la glace.
Masse du palet m = 0,60 kg.
Le joueur propulse le palet à l'aide de sa crosse, sur un plan
recouvert de glace et incliné d'un angle a = 20° par rapport à
l'horizontale. A t=0, le palet est à l'origine du repère. On néglige
les frottements.
Propulsion du palet par la
crosse.
La palette de la crosse est en contact avec le palet.
1. Faire un bilan
des forces qui s'exercent sur le palet et les représenter.
Poids, action du plan et force exercée par la crosse.
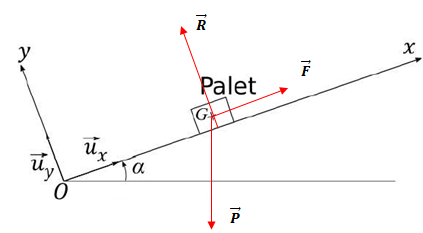
2. Ces forces
ont-elles un caractère moteur, résistant ou sont-elles sans effet lors
du mouvement du palet ?
Le travil du poids est résiatant en montée.
Le travail de la force exercée par la crosse est moteur.
L'action normale du plan ne travaille pas.
f(3/4) = (3-2) / (3/4+1) = 1 /(7 /4) = 4 / 7.
f(1) = 2 / 2 = 1.
3. Déterminer
l'expression de la force F
La seconde loi de Newton projetée sur l'axe Ox donne :
F -mg sin a = ma
; F = m(a+g sin a ).
4 La phase de propulsion dure 0,5
s. Calculer F pour que le joueur égale le record du monde de vitesse
qui est de 50 m /s.
a = vitesse / durée = 50 / 0,5 = 100 m s-2.
F = 0,160 ( 100 +9,81 sin(20))=16,5 N.
Mouvement du palet sur le
plan incliné.
Le palet n'est plus en contact avec la crosse. Son mouvement est
rectiligne vers le haut du plan.
4 Faire un bilan
des forces et les représenter.
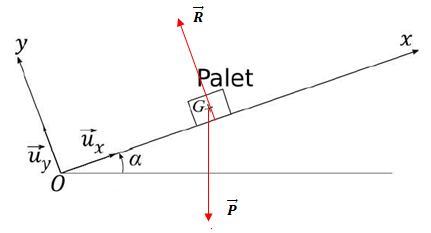
5
Montrer que x(t) vérifie : x "(t) = -g sin(a).
La seconde loi de Newton
projetée sur l'axe Ox donne :
a = x"(t) = -g sin(a).
6 Donner
l’expression de dx/dt puis celle de x(t)..
La vitesse est une primitive de l'accélération : dx/dt = v =-g sin(a)
t+ Cste.
v =-g sin(a) t+ vinitiale.
La position est une primitive de la vitesse.
x = -0,5g sin(a) t2+ vinitiale
t + position initiale.
Si
la position initiale est l'origine : x =-0,5g sin(a)
t2+ vinitiale t.
7 Donner
l'expression de la distance parcourue par le palet, notée d,
avant l'arrêt.
v =-g sin(a)
t+ vinitiale =
0 à l'arrêt.
Durée du parcours : t = vinitiale / g sin(a).
d = -0,5g sin(a)
t2+ vinitiale t = -0,5g sin(a)[vinitiale / g sin(a)]2 + v2initiale / [g sin(a)].
d = -0,5 v2initiale
/ [g sin(a)] + v2initiale / g sin(a)
= v2initiale / [2g sin(a)].
|
...
|
....
|
Exercice 2 : laser.
Une diode laser émet un rayonnement de longueur d'onde dans le vide l = 650 nm.
1. Quelle est la
couleur de ce rayonnement ?
Rouge.
2. Déterminer
l’énergie du photon associé à ce rayonnement en Joules puis en eV
(électronvolt).
E = h c / l =
6,63 10-34 x 3,00 108 / (650 10-9)=3,06
10-19 J.
3,06 10-19 / (1,6 10-19) =1,91 eV.
La puissance du laser est P = 1 mW.
3. Déterminer
l’énergie fournie par le laser en 1s.
Puissance (W) fois durée (s) = 10-3 x1 = 10-3 J.
4. En déduire le
nombre de photons émis en 1s.
10-3 /(3,06 10-19) =3,27 1015.
Le faisceau laser, assimilable à un rayon lumineux, pénètre en un point
I dans un morceau de verre de forme parallélépipédique et d’indice n =
1,5 . L’indice de l’air sera pris égal à 1.
5. Déterminer la
longueur d’onde du laser dans le verre. Sa couleur est elle modifiée ?
Expliquer.
650 / 1,5=433 nm.
La couleur étant liée à la fréquence de l'onde ( et elle-ci est
constante quelque soit le milieu), la couleur n'est pas modifiée.
6. Quelles
phénomènes va subir le faisceau laser en I ? Rappeler le nom des lois
correspondantes.
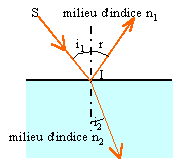
Réflexion dans l'air et réfraction dans le verre.
Lois de Descartes.
7. Sachant que i =
40 °, de combien va être dévié le rayon lumineux lorsqu’il va pénétrer
dans le verre. Justifier votre réponse.
nair sin i = nverre sin i2 ; sin i2
=sin i / nverre = sin 40 / 1,5 ~0,429 ; i2 =25,4°.
Déviation : 40 -25,4 =14,6°.
Exercice 3 : Autour de
l’azote.
L'azote est un élément très abondant à la surface de la terre. Sous la
forme de diazote N2,
il constitue près de 80% de l'air que nous respirons. Il intervient
fréquemment dans l'industrie chimique minérale de base (dite lourde)
qui fabrique divers composés azotés tels que l'ammoniac, l'acide
nitrique ou les engrais azotés.
Donnée : numéro atomique de N : Z=7
1. Déterminer la
configuration électronique de l'azote dans son état fondamental. En
déduire sa position dans le tableau de la classification périodique.
1s2 2s2 2p3. (5 ème colonne de la
classification simplifiée).
2. Déterminer les
électrons de coeur et de valence de l'atome d'azote. En déduire sa
représentation de Lewis.
1s2 ; électrons de coeur ; 2s2
2p3 électrons de valence. 
3. Enoncer avec
soin la règle de l'octet.
règle
de l'octet :
lors de la formation de molécules, les atomes tendent à acquérir la
structure électronique externe du gaz noble le plus proche.
Dans le cas de formation d'ions simples, l'atome gagne ou perd un ou plusieurs électrons, afin d'acquérir la
structure électronique externe du gaz noble le plus proche.
Toutes les atomes dans les structures de Lewis des molécules demandées
devront satisfaire à la règle de l'octet ou du duet.
4. Donner la
formule de Lewis du diazote contenu dans l'air que nous respirons.
5. Donner la
formule de Lewis de l’acide nitrique HNO3
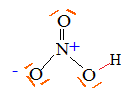
Exercice 4 : Boisson au
cola
La molécule responsable de la forte acidité d’une boisson au cola est
l'acide phosphorique H3PO4
L’acide phosphorique est un triacide faible dont on donne les trois pKA
: pKA1= 2,2 ;
pKA2= 7,2 et pKA3= 12,3.
1. Expliquer le
terme acide faible.
Un acide faible réagit partiellement avec l'eau.
2. Donner les trois
couples acido-basiques issus de l'acide phosphorique.
H3PO4 / H2PO4- ; H2PO4- / HPO42- ; HPO42- / PO43- .
3. Tracer le
diagramme de prédominance de l’acide phosphorique.
Les domaines de prédominance des espèces H3PO4, H2PO4-,
HPO42- et PO43- :
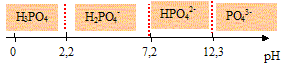
On souhaite déterminer le pH d'une solution aqueuse d'acide
phosphorique, initialement à la concentration C0 = 10-2 mol.L-1.
4. On ne considère que la première acidité de l’acide phosphorique
(couple H3PO4 / H2PO4- )
4.a. Ecrire l'équation bilan de la réaction entre l’acide phosphorique
et l’eau.
H3PO4 aq+ H2O(l) =H2PO4- aq + H3O+aq.
4.b. Donner l’expression de la constante d’équilibre de cette réaction.
KA1 = [H3O+aq ] [H2PO4- aq ] / [H3PO4 aq ].
4.c. Quelle est la valeur de la constante d’équilibre de cette réaction
? Cette réaction est elle très déplacée ?
KA1 =10-2,2 =6,3 10-3, valeur faible, la réaction est partielle.
4.d. Faire un tableau d’avancement pour cette réaction entre l’état
initial et l’état final d’équilibre.
état
|
avancement volumique (mol / L)
|
H3PO4 aq |
+ H2O(l) |
=H2PO4- aq |
+ H3O+aq |
initial
|
0
|
0,01
|
solvant
|
0
|
0
|
en cours
|
x
|
0,01-x
|
x
|
x
|
final
|
xf
|
0,01-xf
|
xf |
xf |
4.e. Déduire des questions précédentes une équation du second degré
vérifiée par la concentration en ions oxonium à l'équilibre..
6,3 10-3 = xf2 / (0,01-xf) ; xf2 +6,3 10-3 xf -6,3 10-5 =0.
La résolution de cette équation donne : [H3O+aq ]= 10-2,2 mol.L-1. En
déduire le pH de la solution.
pH = - log(10-2,2) =2,2.
4.f. Quelles sont les espèces majoritairement présentes à ce pH ?
H3PO4 et H2PO4- .
|
|