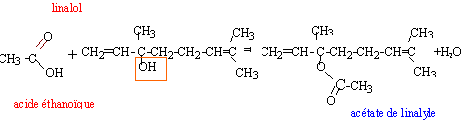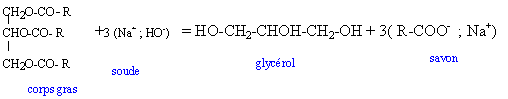|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
|
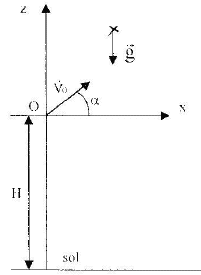
faux : force gravitationnelle exercée par la terre F=GMm/(R+h)² soit G= F(R+h)²/(Mm) par analyse dimentionnelle : force = masse * accélération soit [M][L]² [T]-2. donc G= [M][L] [T]-2[L]² [M]-2=M]-1[L]3[T]-2. vrai : le satellite est soumis uniquement à la force de gravitation dont la direction passe par le centre de la terre. D'après la seconde loi de Newton somme des forces et accélération sont colinéaires et de même sens. Donc l'accélération est centripète. vrai : aN= V²/(R+h) de plus d'après la seconde loi de Newton : aN= GM/(R+h)² d'où V² = GM/(R+h) vrai : le satellite effectue un tour de circonférence 2p(R+h) à la vitesse V en une période T 2p(R+h) = VT soit 4p²(R+h)² = V²T² = GM T² /(R+h) T² = 4p²(R+h)3 / (GM) distance exprimée en m : (R+h)3= (6380 + 12800 ) 103)3=7,05 1021 m3. T² = 4 *3,14²*7,05 1021 / (6,67 10-11*6 1024) = 6,95 108 s² T= 2,64 104 s.
|
||||||||||||||||||||||||||||||||||||
|
Remontons l'écoulement du temps jusqu'à l'instant le plus originel de l'histoire universelle. Au début était la lumière, l'inconstance du monde contenant une incroyable, une fantastique quantité d'énergie. Tout ce que l'univers compte actuellement de galaxie, d'étoiles, de planètes, d'êtres ou d'objets était là en germe sous forme d'énergie immatérielle. La théorie du big bang sans cesse réaffirmée esplique que,
durant le premier quart d'heure, de ce chaos énergétique très agité
sont nées les particules de matière fondamentales : protons, neutrons,
électrons... Après les particules de base, mais bien plus tard des
galaxies prennent forme, puis des étoiles apparaissent dans les
galaxies. Par le truchement de la nucléosynthèse, la varièté des
éléments chimiques voit enfin le jour dans les étoiles...
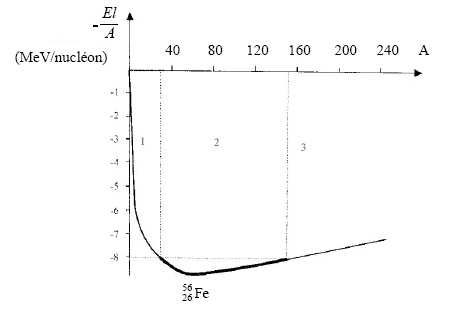
E énergie de masse en joules (J) ; masse en kilogrammes (kg) ; c célérité de la lumière en m/s. E = 2m.c²= 2*9,11 10-31*(2,998 108)² = 1,64 10-13 J diviser le résultat précédent par 1,602 10-19 pour passer au eV E = 1,02 106 eV = 1,02 MeV. Composition d'un noyau de deutérium : Z =1 doncun proton et A-Z = 1 soit 1 neutron. 01e représente un positron, antiparticule de l'électron. réaction de fusion thermonucléaire dans laquelle il y a conservation du nombre de nucléons et du nombre de charges. perte de masse = mHe + 2me - 4mH=( 6,6447+ 2*9,11 10-4 - 4 * 1,6726)10-27= - 4,3878 10-29 kg. Une particule a est un noyau d'hélium . triple alpha : il y a fusion de trois noyaux d'hélium, de trois particules a. L'énergie de liaison est l'énergie qu'il faut fournir à un noyau pris au repos pour le dissocier en ses nucléons séparés et au repos. El = Dm.c² avec Dm : défaut de masse (masse des nucléons séparés - masse du noyau) El étant positive, Dm est positif ; El s'exprime en J ou en MeV. Pour le carbone 12: El =92,2/12 = 7,68 MeV. Le noyau de fer est le plus stable car son énergie de liaison par nucléon est la plus élevée. La dissociation de ce noyau en ces nucléons isolés nécessite le plus d'énergie. courbe d'Aston : domaine 1 : si A augmente, alors El/A augmente. En conséquence la stabilité des noyaux augmente. Des réactions de fusion nucléaire des petits noyaux conduisent des noyaux avec un nombre de nucléons plus élevés, et donc plus stables. domaine 2: si A augmente, alors El/A varie peu. Les noyaux sont donc stables. domaine 3: si A augmente, alors El/A diminue. En conséquence la stabilité des noyaux diminue. Des réactions de fission nucléaire des gros noyaux donnent des noyaux avec un nombre plus faible de nucléons, et donc plus stables. La synthèse des éléments chimiques au cœur des étoiles conduit à l'élément fer, celui-ci étant le plus stable des noyaux, il ne peut fissionner ou fusionner. En gagnant un neutron, le noyau ne modifie pas son numéro atomique Z. Or le numéro atomique caractérise un élément chimique. Ce scénario conduit aux isotopes d'un noyau mais pas de créer de nouveaux éléments chimiques. Désintégration b- : AZX --> AZ+1X + 0-1e+ 00 g un électron est émis et il se forme un noyau fils dans un état excité; ce dernier sedésexcitation avec émission de rayonnement électromagnétique g. Les deux scénarios peuvent être à nouveau envisagés pour le noyau fils. Un nouvel élément chimique de numéro atomique supérieur sera formé. Néanmoins les noyaux possédant un grand nombre de nucléons ( Z et de A de valeurs élevées), seront instables et subiront des désintégrations a ( Z diminue de 2 dans une désintégration a)et en conséquence le numéro atomique cessera de croître.
|
|||||||||||||||||||||||||||||||||||||
|
A. Préparation du parfum à odeur de lavande : Le perfum à odeur de lavande, ou acétate de linalyle, utilisé pour parfumé le savon est une espèce chimique présente dans l'essence naturelle de lavande. Mais il peut aussi être préparer en laboratoire, entre autre apr action de l'acide acétique sur le linalol. A température ordinaire le linalol se présente sous forme d'un liquide incolore et odorant, de formule semi-développée : 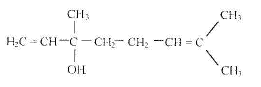
B- Préparation du savon : Les savons durs sont des carboxylates de sodium représentés par la formule générale RCOONa où R est une chaîne carbonée linéaire comprtant de 10 à 20 atomes de carbone. Ils sont préparés par action de la soude sur les corps gras qui sont des triesters du glycérol. Le glycérol a pour formule semi-développée HOCH2-CHOH-CH2OH.
Donnée : zones de virage et teintes de l'alizarine : jaune à pH<10 et mauve à pH >12 ; zone de virage [10 ; 12] corrigé Le groupe caractéristique de la fonction alcool est le groupe -OH lié à un carbone tétragonal. L'acétate de linalyle appartient à la famille des esters.
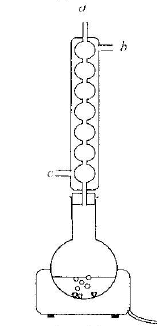
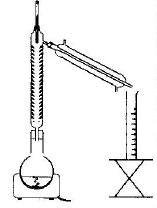
La réaction d'estérification est lente, athermique et limitée par l'hydrolyse de l'ester. Un catalyseur est une espèce chimique qui augmente la vitesse de la réaction. Le taux d'avancement final n'est pas modifié en sa présence. Il n'apparaît pas dans le bilan de la réaction chimique. Quotient de réaction initial : Qri = [ester]0[eau]0/([acide éthanoique]0[linalol]0) or [ester]0=0 donc Qri = 0 valeur inférieure à la constante d'équilibre ; en conséquence réaction spontanée dans le sens direct, formation de l'ester et de l'eau. Le chauffage à reflux permet d'augmenter la température du milieu réactionnel (donc d'augmenter la vitessesla transformation chimique). La condensation des vapeurs permet d'éviter toute perte de matière. L'eau circule depuis le bas du réfrigérant (c) vers le haut du réfrigérant (b). La transformation est limitée, en conséquence dans l'état final tous les réactifs ne sont pas consommés : ces derniers coexistent avec les produits : acide acétique, linalol, eau et acétate de linalyle. figure 2 : montage de distillation fractionnée. séparation des différentes espèces présentes dans le ballon en fonction de leurs températures d'ébullition. L'eau est, dans ce cas l'espèce la plus volatile, elle sera donc d'abord extraite du milieu réactionnel et récupérée dans l'éprouvette graduée. Quand toute l'eau a été distillée, l'acide acétique ( devenu le plus volatil) entrera en ébullition. Il sera récupérer dans une autre éprouvette graduée. Pui se sera le tour du linalol et l'acétate de linalyle restera dans le ballon. le rendement de la synthèse : Le mélange initial étant équimolaire, les réactifs sont en proportions stœchiométriques. Qté de matière (mol) de linalol : masse (g) / masse molaire (g/mol) avec masse (g) = volume (mL) * densité linalol m= 40*0,87 = 34,8 ; n alcool = 34,8 / 154 = 0,226 mol en conséquence on peut espérer obtenir au plus 0,226 mol d'ester. Qté de matière (mol) d'ester : masse (g) / masse molaire (g/mol) avec masse (g) = volume (mL) * densité ester m= 2,5*0,89 = 2,225 g ; n ester réelle = 2,225/196 = 0,011 mol rendement = 100 * Qté de matière réelle/ Qté de matière thèorique = 100 * 0,011 / 0,226 = 5%. En éliminant l'eau ( la plus volatile des produits dans ce cas) au fur et à mesure qu'elle se forme par distillation fractionnée, on déplace l'équilibre vers la formation de l'ester. En remplaçant l'acide acétique par l'anhydride acétique dans le montage de chauffage à reflux, on rend la transformation totale. préparation du savon :
La saponification du corps gras est totale et lente. L'oléate de sodium, le savon, est très peu soluble dans l'eau salée. Donc le savon précipite. Phase finale : Le savon est de couleur mauve, couleur due au jaune d'alizarine. La couleur de l'indicateur coloré indique que le savon est très basique : pH supérieur à 12. Lors de la fabrication du savon, la soude est utilisée en large excès. Le savon, contenant encore de la soude, est corrosif.
|
|||||||||||||||||||||||||||||||||||||
|
|