|
- pression et écoulement (8 points) d'après bac SMS 2004 Calculatrice autorisée En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
|
||
|
|
||
|
|
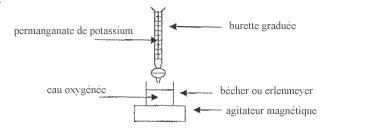
eau oxygénée : L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène de formule H2O2. A température ordinaire, le peroxyde d'hydrogène se décompose lentement selon l'équation-bilan : H2O2+ H2O2----> 2 H2O + O2.
corrigé H2O2+ H2O2----> 2 H2O (eau) + O2 ( dioxygène) Couples redox mis en jeu lors de la transformation chimique : forme oxydante forme réductrice H2O2 / H2O O2 / H2O2 Le peroxyde d'hydrogèneH2O2 joue à la fois le rôle d'oxydant et le rôle de réducteur : la réaction d'oxydoréduction est donc une dismutation. l'équation-bilan du dosage : 2 fois {MnO4-
+ 5e- + 8H+ = Mn2+ +4H2O} ______________________________________________ 2 MnO4- + 6 H+ + 5 H2O2----> 2 Mn2+ + 8 H2O + 5 O2
A l'équivalence d'un dosage, les réactifs sont introduits dans les proportions stœchiométriques. concentration en peroxyde d'hydrogène de l'eau oxygénée : CH2O2 = 2,5 CMnO4- Véqui/ VH2O2. Le titre de l'eau oxygénée : T = 11,2 x 5,4 x 10-2= 0,6 volume.
|
|
|
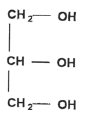
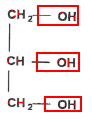
Le savon de Marseille Le savon de Marseille est fabriqué à partir d'huile d'olive qui contient l'oléine de formule chimique : 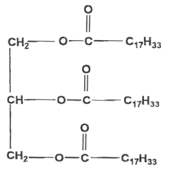
corrigé 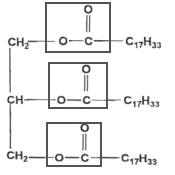
La molécule d'oléine comporte 3 groupes fonctionnels identiques ester. L'oléine est un triglycéride car c'est un triester formé à partir d'un acide gras et du glycérol..
La molécule de glycérol possède 3 groupes fonctionnels : deux groupes alcool primaire et un groupe alcool secondaire. La réaction de saponification est lente mais totale. le glycérol est soluble dans la phase aqueuse. l'ion oléate : la partie hydrophile est le groupe -COO- et la partie hydrophobe est la chaine carbonée C17 H33-. Masse molaire du savon : C17H33-COO- + Na+. M = 18 x 12 + 33 +2 x 16 + 23= 304 g.mol-1. (1 mole) d'oléine conduit à (3 moles) de savon donc n0 = 1000 moles d'oléine conduisent à 3 n0 = 3000 moles de savon. masse de savon obtenue : = 3000* 304 =912 000 g = 912 kg.
|
||
|
pression et écoulement Une personne hospitalisée peut déambuler dans un couloir en emmenant avec elle une perfusion contenant un volume V = 0,5 L d'eau glucosée suspendue à un crochet adapté à un support mobile. On rappelle que 1L = 10-3 m3. 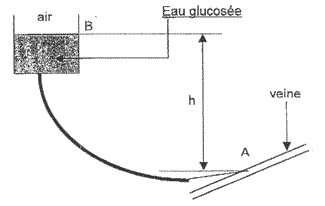
corrigé r= m/ V m = masse du corps (en kilogramme : kg) V = volume du corps (en mètre cube : m3) r = masse volumique du corps (en kilogramme par mètre cube : kg.m-3). r =0,525 / 5 10-4 = 1050 kg m-3.
Or 1 mm de mercure est équivalent à 133,3 Pa donc T = 60* 133,3 = 8000 Pa. loi de la statique des fluides : T =r g h hauteur minimale h entre les points B et A, pour que le liquide puisse pénétrer dans la veine : hmini
= T / ( g h) = 8000 / (1050*10) = 0,76 m.
v = 4 10-8 / 4 10-6 = 0,01 m/s.
|
||
|
|