|
électrocution ; solénoïde ; condensateur ; lentilles. d'après concours aide technique laboratoire groupe Nord 2001 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
||
|
|
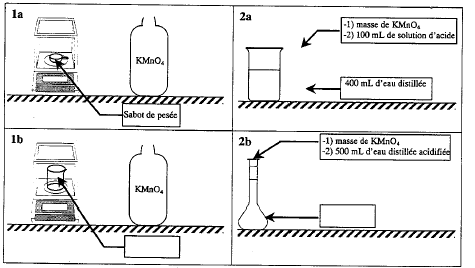
Préparation par pesée d'une solution acidifiée S de permanganate de potassium de concentration volumique 0,010 mol/L.
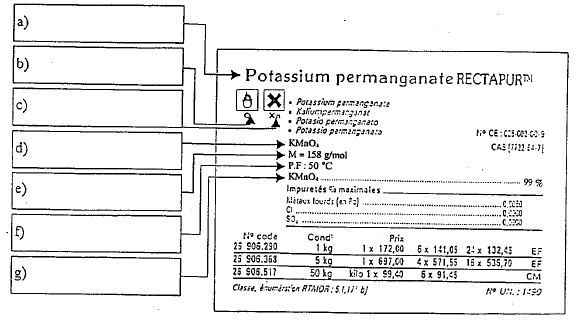
a : nom du produit ; b : risque : comburant ; c : risque : nocif ou irritant ; d : formule chimique e : masse molaire (g/mol) ; f : tempéarture de fusion du solide ; g : pureté 0,01 / 2 = 5 10-3 mol KMnO4 dans 500 mL masse (g) = masse molaire (g/mol) * Qté de matière (mol) = 158 * 5 10-3 = 0,79 g. 1b : bécher ; 2 b : fiole jaugée. on utilise l'acide sulfurique : les ions chlorures ( bromures) de l'acide chlorhydrique( bromhydrique) sont oxydés en dichlore ( dibrome) par l'ion permanganate ; l'ion sulfate ne s'oxyde pas. Précautions : port de blouse, gants et lunettes ; verser l'acide dans l'eau et non l'inverse. FeSO4, (NH4)2SO4, 6H2O 5 Fe2+ = 5 Fe3+ + 5e- oxydation MnO4- + 8H+ + 5e- = Mn2+ + 4H2O réduction MnO4- + 8H+ + 5Fe2+ = 5 Fe3+ +Mn2+ + 4H2O oxydo-réduction L'ion permanganate violet est un réactif et l'indicateur de fin de réaction : à l'équivalence passage de la couleur violette à l'incolore. flacons opaques à la lumière. concentration massique en KMnO4 : 0,01 mol/L soit 0,01*158 = 1,58 g/L On n'effectue aucune dilution, donc on prélève le volume de 250 mL de façon peu précise. ne pas mettre à l'évier du fait de la présence d'ions de métaux lourds ( Mn2+ et Fe3+)
|
|
|
Masse atomique molaire en g/ mol : Cl : 35,5 ; H : 1 ; N : 14. Ka ( NH4+/ NH3 ): 6,3 10-10 . On désire préparer VT= 50 mL d'une solution tampon ammoniacale de pH= 9,2.
corrigé pKa = - log Ka = -log 6,3 10-10 = 9,2. Le pH d'une solution tampon ne varie pas par dilution ; le pH d'une solution tampon varie peu lors de l'ajout modéré d'un acide ou d'une base. L'ammoniaque est une base faible. masse de chlorure d'ammonium (g) = masse molaire (g/mol) * Qté de matière (mol) masse molaire NH4Cl : 14 + 4 +35,5 = 53,5 g/mol Qté de matière (mol) = volume solution (L) * concentration (mol/L) = 0,05*0,4 = 0,02 mol m = 53,5*0,02 = 1,07 g. facteur de dilution = concentration mère / concentration fille = 2 / 0,4 = 5 prélever 50/5 = 10 mL de solution mère. NH3 + H3O+ = NH4+ + H2O Va : volume d'acide ; Vb : volume de solution S On réalise un dosage acide base avec arrêt à la demi équivalence ( ammoniaque dans le bécher et acide dans la burette. à l'équivalence d'un tel dosage, les quantités de matière des réactifs sont dans les proportions stoéchiométriques n( acide) = n( ammoniaque) ; Va*[HCl]= Va*1 = Va ; n( ammoniaque) = Vb[NH3]= 2Vb. à la demi-équivalence : n( acide ajouté )= ½ n( ammoniaque initiale) soit V a= Vb de plus : n( NH4 +) = 0,4 *0,05 = 0,02 mol soit n( acide ajouté ) = 0,02 mol d'où Va = 0,02 L = 20 mL compléter avec de l'eau distillée dans une fiole jaugée de 50 mL.
|
||
|
On représente un modèle équivalent du corps humain valable pour les courants entrant ou sortant du corps au niveau des extrémités, à savoir, les mains, les pieds, la tête. Dans ce modèle on néglige la résistance du tronc devant la résistance des membres. Chaque membre a une résistance R et la tête une résistance R/5. 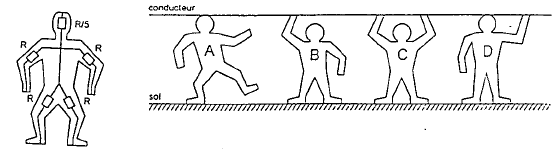
corrigé A : un membre et la tête : R + R/5 = 6/5R = 1,2 R B : deux pieds ( identiques à deux résistances R en parallèle soit réqui = ½R) et un bras : R + ½R = 3/2R = 1,5 R C : deux pieds ( identiques à deux résistances R en parallèle soit réqui = ½R) et deux bras ( identiques à deux résistances R en parallèle soit réqui = ½R) : ½R + ½R = R D : deux pieds ( identiques à deux résistances R en parallèle soit réqui = ½R) et la tête + un bras ( équivalent à R et 0,2 R en parrallèle soit r équivalent = 0,2R² / (1,2 R) = R/6) : total : ½R + R/6 = 2/3 R= 0,67 R. D est la plus en danger car la résistance de cette personne est la plus faible ; or à tension constante, l'intensité du courant est d'autant plus grande que la résistance est plus petite. A : I= 20 / (1,2*500) = 20/600= 0,033 A = 33 mA ( 33 >30 mA, donc danger de mort) B : I= 20 / (1,5*500) = 20/750= 0,026 A = 26 mA ( 26 <30 mA, donc pas de danger de mort) C : I= 20 / 500 = 0,04 A = 40 mA ( 40 >30 mA, donc danger de mort) D : I= 20 / (0,67*500) = 20/335= 0,06 A = 60 mA ( 60 >30 mA, donc danger de mort)
|
||
|
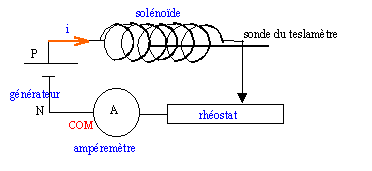
corrigé aimant, limaille de fer, plaque de plexiglass; petites boussoles sur pivot , diverses bobines traversées par un courant continu montées sur support transparent, générateur de tension continu + rhéostat ( 10A) , rétroprojecteur.
résistance totale du circuit : 25 / 4 = 6,25 W. La résistance électrique du solénoïde étant très faible, le rhéostat doit avoir une résistance minimale de 6 ohms et doit pouvoir supporter une intensité de 4 A.
|
||
|
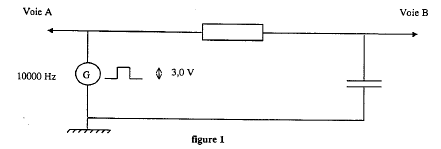
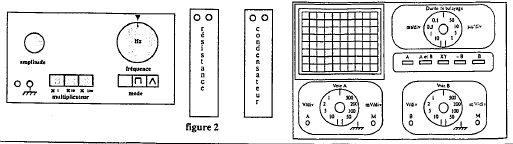
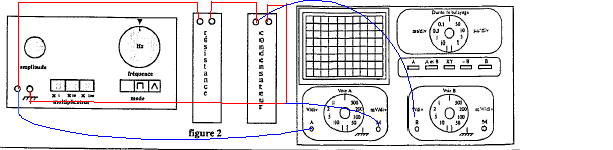
Pour étudier la charge d'un condensateur à l'oscilloscope un professeur demande le matériel ci-dessous : GBF, boîte de résistance à décades, boîte de condensateur à décade, oscilloscope.
corrigé Le GBF ( signale rectangulaire) simule l'ouverture et la fermeture du circuit comprenant en série le condensateur, une résistance.( charge et décharge successives du condensateur) boîte à décade : ensemble de résistance variable par unité, dizaine, centaine....
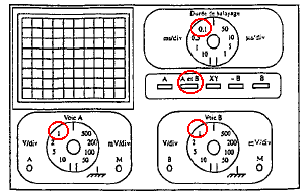
molette des fréquences sur 100 Hz et sélectionner le facteur multiplicateur 10 ; sélectionner le mode fonction rectangulaire. Appuyer sur la touche A et B , 1V/div voie A et B, 0,1 ms/div ( fréquence 1000 Hz : période 1 ms et 10 divisions sur l'axe horizontal)
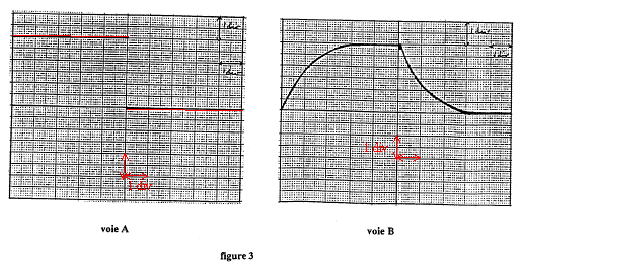
charge du condensateur suivie de la décharge du condensateur à travers le résistor. 50 ms/div et 10 divisions sur l'axe horizontal : la durée correspondante est de 50*10 =500ms= 0,5 ms, soit une demi-période.
On visualise voie A un trait horizontal situé à 3 V ( première demi-période). On peut aussi visualiser un trait situé au centre de l'écran ( seconde demi-période)
|
||
|
Un professeur demande le matériel nécessaire pour étudier les formules des lentilles convergentes.
corrigé
La vergence de la lentille est + 8 dioptries ; la distance focale image de la lentille est 1/8 = 0,125 m L'objet n'est pas situé entre le centre optique et le foyer principal objet de la lentille: l'image sera donc réelle, inversée par rapport à l'objet, située à droite de la lentille. formule de conjugaison : p : mesure algébrique OA ; p' : mesure algébrique OA' 1/f = 1/ p' - 1/p soit 1/p' = 1/f' + 1/p = 8 +1/(-0,5) = 6 ; p'= 1/6 = 0,17 m grandissement
transversal g = p'/p = 0,17 / (-0,5) = -0,34, image plus
petite que l'objet.
|
||
|
|
||