|
d'après concours manipulateur radio Rennes. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
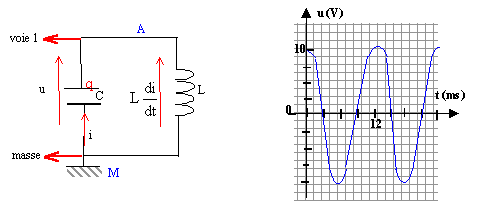
corrigé Charge finale Q0 du condensateur : Q0= C U = 33 10-6 * 10 = 3,3 10-4 C. Energie emmagasinnée par le condensateur en fin de charge : ½Cu²= 0,5 * 33 10-6 * 100 = 1,65 10-3 J.
On visualise la tension u(t) aux bornes du condensateur. Echange d'énergie entre le condensateur initialement chargé et la bobine inductive. u(t) = Ldi/dt avec i = - dq/dt ; di/dt = - d²q/dt²; or q=C u(t) soit di/dt = - Cd²u(t) / dt² = -C u" u = -LC u" soit u+LC u"=0 ou encore u" + w² u=0 avec w ²= 1/(LC)= 1/(33 10-6 *0,12)=2,52 105 soit w = 502,5 rad/s. période propre T0 = 2p/w= 6,28 /
502,5 = 12,5 10-3 s = 12,5 ms.
q(t) = C u(t) = CUcos (wt) = Q0 cos (wt) = 3,3 10-4 cos (502,5 t) i(t) = - dq(t) / dt = wQ0 sin (wt) intensité maximale ou amplitude = wQ0 =
502,5 * 3,3 10-4 = 0,166 A.
Lors des échanges d'énergie entre condensateur et bobine, une partie est dissipée en chaleur ( effet joule) dans la résistance. On observe un amortissement ( l'amplitude des oscillations peut rapidement diminuer). Pour visualiser un phénomène non répétitif on peut utiliser un oscilloscope à mémoire.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On se propose d'étudier la cinétique de la réaction entre les ions permanganate (violet) et l'acide oxalique ( incolore) de formule C2H2O4.
corrigé 2 fois { MnO4- + 8H+ + 5e- = Mn2+ + 4H2O } réduction 5 fois { C2H2O4 = 2 CO2 + 2H+ + 2e- }oxydation puis additionner : 2 MnO4- + 5 C2H2O4 + 16H+ + 10e- = 2 Mn2+ + 8 H2O+ 10 CO2 + 10H+ + 10e- 2 MnO4- + 5 C2H2O4 + 6H+ = 2 Mn2+ + 8 H2O+ 10 CO2 Quantité de matière initiale en acide oxalique (mol) = concentration (mol/L) * volume (L) n C2H2O4= 0,5*0,020=0,01 mol.
Les quantités de matière sont en proportions stoéchiomètriques si : nMnO4- = 2/5 n C2H2O4 = 2*0,01 / 5 = 4 10-3 mol. Quantité de matièreréelle initiale en ion permanganate (mol) = concentration (mol/L) * volume (L) nMnO4- = 0,2*0,020=0,004 mol. il y a suffisamment d'ion permanganate
pour oxyder tout l'acide oxalique.
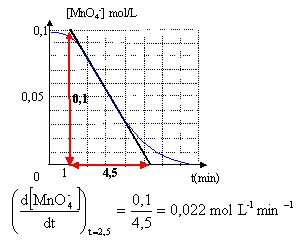
La couleur violette disparaît peu à peu au fur et à mesure de la disparition de l'ion permanganate ; à la fin de la réaction la solution est incolore. concentration (mol/L) = Qté de matière (mol) / volume solution (L) [MnO4- ]0
= 4 10-3 / ((20 + 20 ) 10-3) = 0,1 mol/L.
A et [MnO4-] sont proportionnelles : 160 *0,1 / 166 = 0,096 ; 154*0,1 / 166 = 0 093
A t= 0 la tangente à la courbe est pratiquement horizontale ; son coefficient directeur est proche de zéro.
La vitesse de la réaction est faible pendant les deux premières minutes ( la quantité de matière du catalyseur Mn2+ est faible), puis elle augmente rapidement ( la quantité de matière du catalyseur Mn2+ est grande), puis elle diminue pour s'annuler ( la quantité de matière des réactifs diminue avec le temps). L'un des produits de la réaction sert de catalyseur. (
autocatalyse)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|