1. Calculer la concentration d'une solution telle que C= 2 mol/L après la dilution suivante : 200 mL d'eau + 300 mL de solution.
de dilution = volume final / volume initial de solution = 500/300 = 1,67.
concentration finale = concentration initiale par le facteur de dilution = 2/1,67 =2*300/500 = mol/L
2. Comment diluer 100 fois une solution basique ? Comment évolu le pH ?
jaugée de 100 mL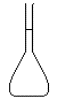 et jaugée
et jaugée 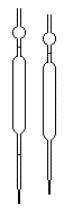 de 1 mL : compléter avec de l'eau distillée.
de 1 mL : compléter avec de l'eau distillée.
Pa dilution le pH se rapproche du pH neutre (pH= à 25°C)
3. Un produit organique a pour formule 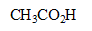 . Deux ions existent en solution : l'un d'eux est l'ion
. Deux ions existent en solution : l'un d'eux est l'ion 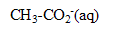
a) Ecrire l'autre ion forme : ion 
b) Comment évoluele pH d'une solution dans laquelle on ajoute ce produit.
En ajoutant un dans une solution aqueuse, on observe une diminution du pH.
4. A 20 mL d'une solution d'acide chlorhydrique à 2,0 mol/L, on ajoute 120 mL de solution d'hydroxyde de sodium pour obtenir l'équivalence. Quelle est la concentration de la solution basique ?
A l' les quantités de matière des réactifs sont en proportions stoéchiométriques.
 +
+ 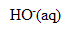 = 2
= 2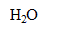
Quantité de matière (mol) = volume (L) * concentration (mol/L)
n(acide)= 0,02*2 = 0,04 mol
n(base) = 0,12 C
d'où C= 0,04/0,12 = mol/L.
5) Un becher contient 200 mL d'acide chlorhydrique à 0,5 mol/L. Un autre contient 250 mL de solution de soude à 0,8 mol/L. Calculer les quantités de matière initiale puis finale d'ions oxonium et hydroxyde. En déduire le pH final du mélange.
Quantité de matière (mol) = volume (L) * concentration (mol/L)
Initial : n(acide)= 0,2*0,5 = 0,1 mol ; n(base) = 0,25*0,8 = 0,2 mol
 +
+ 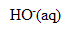 = 2
= 2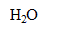
Fin : l'acide en défaut a disparu en réagissant avec 0,1 mol de la solution basique : il reste donc 0,1 mol d'ion hydroxyde dans un volume V= 450 mL= 0,45 L
[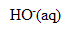 ]= 0,1/0,45 = 0,222 mol/L
]= 0,1/0,45 = 0,222 mol/L
pH d'une solution de soude : pH= 14 + log 0,222 = .