L’eau de Javel est une solution aqueuse d’hypochlorite de sodium (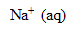 +
+ 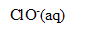 ) et de chlorure de sodium (
) et de chlorure de sodium (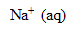 +
+ 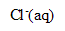 ) en milieu basique.
) en milieu basique.
Elle est préparée par réaction directe entre le dichlore et la solution aqueuse d’hydroxyde de sodium. Cela correspond à la dismutation du dichlore ; le dichlore est à la fois réduit et oxydé.
Les couples en jeu sont : 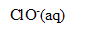 /
/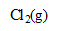 et
et 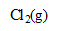 /
/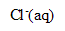 .
.
1. Compléter l'équation chimique modélisant la préparation de l’eau de Javel.
2.

Volume (L) de dichlore gazeux, mesuré sous 101,3 kPa à 0°C, nécessaire pour fabriquer un litre de solution d'eau de Javel.
- Quelle est la relation entre le degré chlorométrique et la concentration molaire des ions hypochlorite.
- Calculer la concentration, notée C des ions hypochlorite dans une solution d'eau de Javel titrant 12 degrés. Volume molaire des gaz : Vm=22,4 L/ mol.
Quantité de matière de dichlore (mol) = volume (L)
par le volume molaire des gaz (L/mol) = degré / Vm = 12 / 22,4 =
mol
D'après les coefficients de l'équation, les quantités de matière de dichlore et d'ion hypochlorite sont
: n( ClO-)= degré/Vm = 0,54 mol
De plus le volume de la solution est de 1L, d'où la concentration en ion hypochlorite : C= 0,54 mol/L
3.


Erlenmeyer : on dissout 2,0 g d’iodure de potassium (KI) dans 50 mL d’eau distillée ; on y ajoute 10 mL d’acide éthanoïque.
Burette : solution titrée de thiosulfate de sodium
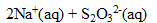
de concentration molaire apportée 0,10 mol/L.
Ajouter 2 mL d'eau de Javel à doser ( concentration notée C) dans l'erlenmeyer. Une coloration brune apparaît en agitant.

Ajouter lentement la solution de thiosulfate de sodium ; dès que la solution de l'erlenmeyer est jaune, ajouter quelques gouttes d’empois d’amidon ; reprendre l'ajout de thiosulfate de sodium jusqu’à décoloration du mélange réactionnel. Le volume de solution de thiosulfate de sodium ajouté à l’équivalence est Véqui = 20 mL.

La coloration brune résulte de l’oxydation des ions iodure, par les ions hypochlorite, en ions triiodure. Ecrire l’équation (1) associée à cette réaction.
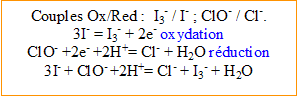
- Quel est le réactif en défaut ? ( masse molaire de l’iodure de potassium : 166 g/mol).
* Quantité de matière KI (mol) = masse (g)
par la masse molaire (g/mol) = 2/166 =0,012 mol
d'où la quantité de matière initiale d'ion iodure n(I-) = 0,012 mol
* Quantité de matière d'ion hypochlorite (mol) = concentration (mol/L)
volume de la solution (L) = 0,54*0,002 = 0,00108 mol
* D'après les coefficients de l'équation (1), 0,00108 mol d'ion hypochlorite réagit avec 3*0,00108 = 0,00324 mol d'ion iodure. Or on a 0,012 mol d'ion iodure, valeur bien supérieure à 0,00324 : donc les ions iodures sont en
.
- La réaction est totale : quelle est la quantité de matière d'ions triiodure formés ?
* Etablir le raisonnement à partir du réactif en défaut, l'ion hypochlorite
* D'après les coefficients de l'équation (1), les quantités de matière d'ion hypochlorite et d'ion triodures sont
.
n(ion triiodure) = 0,00108 mol.

Réaction du dosage : réduction des ions triiodure (formés lors de la réaction (1)) en ions iodure par les ions thiosulfate.
- Ecrire l’équation (2) associée à cette réaction.
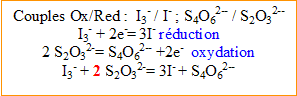
- Quelle est la quantité de matière d'ions triiodure dosés ?
A l'
du dosage, les quantités de matière des réactifs mis en présence sont en proportions stoéchiomètriques.
D'après les coefficients de l'équation du dosage, la quantité de matière d'ion thiosulfate est égale à
fois la quantité de matière d'ion triodure.
n( thiosulfate) ( mmol) = volume équivalent (mL) fois concentration thiosulfate de sodium = 20*0,1 = 2,0 mmol
d'où la quantité de matière d'ion triodure dosés : n( triodure) = 1,0 mmol.
- En déduire la concentration en ion hypochlorite de l'eau de Javel puis son degré chloromètrique.
D'après l'équation de l'étape (1), les quantités de matière d'ion hypochlorite et d'ion triodure sont identiques.
D'où la quantité de matière d'ion hypochlorite : n ( hypochlorite )= 1,0 mmol contenu dans 2 mL de la prise.
Concentration des ions hypochlorite dans l'eau de Javel : 1/ 2 = 0,5 mol/L
En conséquence la quantité de matière de dichlore est 0,5 mol/L
Degré chlorométrique : quantité de matière dichlore fois volume molaire des gaz = 0,5* 22,4 = 11,2 degrés chlorométriques
Soit un écart relatif égal à : (12-11,2) / 12 *100 = 7 %.