En solution aqueuse, le peroxyde d'hydrogène 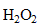 réagit avec le dioxyde de soufre
réagit avec le dioxyde de soufre 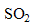 pour donner des ions sulfate
pour donner des ions sulfate 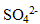 et des ions
et des ions 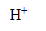 .
.
1. Écrire l'équation chimique symbolisant cette réaction.
réduction de l'eau oxygénée :
oxydation du dioxyde de soufre :
oxydo-réduction:
2. Une solution A de dioxyde de soufre est préparée en dissolvant 3,2 g de dioxyde de soufre dans 250 mL d'eau pure. Calculer la concentration molaire apportée pour le SO2 dans cette solution. La masse molaire du dioxyde de soufre est de 64 g.mol-1.
quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 3,2/64 =
mol de dioxyde de soufre.
concentration molaire (mol/L= quantité de matière (mol) / volume (L) de la solution = 0,050 / 0,25 =
mol/L
3.On prélève 20 mL de la solution A que l'on dilue pour obtenir un volume de 100 mL( solution B). Quelle est la concentration molaire apportée de cette solution B en dioxyde de soufre?
facteur de dilution 100 / 20 = 5. La solution B est cinq fois moins concentrée que la solution A soit 0,20/5 =
10 exposant -2 mol/L
4. On dispose d'une solution de peroxyde d'hydrogène à 0,10 mol.L-1. Quel volume de cette solution doit-on ajouter aux 100 mL de la solution B pour atteindre l'équivalence?
A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions
.
Quantité de matière dioxyde de soufre : concentration (mol/L) * volume de la solution (L) = 0,04*0,1 = 4 10^ -3 mol =
mmol.
Quantité de matière d'eau oxygénée : 0,1 V mmol ( V étant le volume(mL) ajouté)
D'après les coefficients de l'équation ci-dessus : 4 = 0,1 V soit V =
mL.
5.Quelle est la quantité d'ions H+aq libérés ?
D'après les coefficients de l'équation ci-dessus :
*4 = 8 mmol.
En solution aqueuse, le peroxyde d'hydrogène
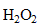
réagit avec le dioxyde de soufre
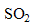
pour donner des ions sulfate
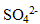
et des ions
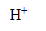
.