On introduit dans un bécher 100 mL d'une solution de thiocyanate de potassuim 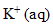
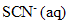 et 100 mL d'une solution de chlorure de fer 3
et 100 mL d'une solution de chlorure de fer 3 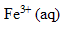 + 3
+ 3 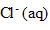 . Ces deux solutions sont de même concentration en soluté apporté égale à 0.010 mol/L. Il se forme un complexe de formule
. Ces deux solutions sont de même concentration en soluté apporté égale à 0.010 mol/L. Il se forme un complexe de formule 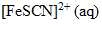 appélé thiocyanoferate III.
appélé thiocyanoferate III.
Quelle est la concentration des ions dans l'état final du système ? Vérifier que la solution est électriquement neutre.
Quantité de matière(mol) initiale des ions = concentration (mol/L) * volume de la solution (L)
- ion potassium : 0,01*0,1 = 0,001 mol = mmol
- ion thiocyanate : 0,01*0,1 = 0,001 mol = 1,0 mmol
- ion fer III : 0,01*0,1 = 0,001 mol = 1,0 mmol
- ion chlorure : *0,01*0,1 = 0,03 mol = 3,0 mmol
| avancement (mmol) | 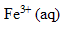 | +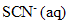 | =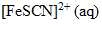 |
| initial | 0 | 1,0 | 1,0 | 0 |
| en cours | X | 1,0-X | 1,0-X | X |
| fin | Xf | 1,0-Xf | 1,0-Xf | Xf |
Si l'ion fer III est en
: 1,0-Xf=0 soit Xf= 1,0 mmol
si l'ion thiocyanate est en défaut : 1,0-Xf=0 soit Xf= 1,0 mmol
Les réactifs sont en proportions
.
Quantité de matière finale des ions :
- ion potassium et ion chlorure inchangée ( ions spectateurs)
- ion fer III et ion thiocyanate :
.
- ion thiocyanoferrate III :
mmol.
Volume total de la solution :
mL.
Concentration (mol/L) = quantité de matière (mmol) / volume total ( mL)
[ ion chlorure] = 3 / 200 =
mol/L
[ion potassium]= 1/200 =
mol/L
[thiocyanoferrate III]= 1/200 = 0,0050 mol/L
[
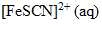
]+[
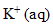
]=[
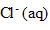
]
2*0,005 +0,005 = 0,015
La solution est électriquement neutre.