On étudie l’évolution au cours du temps, d’un mélange constitué de 100 mL de solution d’acide oxalique ( acide éthanedioïque) à 60,0 mmol/L et 100 mL de solution de dichromate de potassium acidifiée à 16,6 mmol/L . Couples redox : 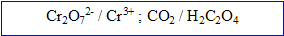
a) Définir les mots oxydants, réducteur, forme oxydante, forme réduite, oxydoréduction.
b) Ecrire chaque demi-équation électronique puis l'équation bilan.
c) Les réactifs sont-ils en proportions stoéchiomètriques ? Si la réponse est non, quel est le réactif limittant ?
d) Quelle est la concentration finale en ion chrome(III) ?

Un couple redox est constitué de deux espèces telles que : 
On écrit en premier la forme oxydante du couple, en seconde la forme réduite : 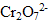 est la forme du couple
est la forme du couple 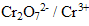
.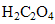 est la forme du couple
est la forme du couple 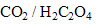
Une réaction d'oxydoréduction met en jeu deux couples redox : il y a un transfert d' de la forme réduite d'un couple à la forme oxydante de l'autre couple redox. Au cours de cette réaction 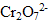 joue le rôle d' ( espèce qui gagne un ou plusieurs électrons),
joue le rôle d' ( espèce qui gagne un ou plusieurs électrons), 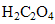 joue le rôle de ( espéce qui perd un ou plusieurs électrons).
joue le rôle de ( espéce qui perd un ou plusieurs électrons).
Dans le bilan de l'oxydoréduction les électrons n'apparaissent pas : dès qu'ils sont libérés par le réducteur ils sont gagnés par l'oxydant. On va donc mutiplier par
la seconde demi équation électronique ; puis faire la somme des deux demi équations.
Quantité de matière (mmol) = concentration (mmol/L) * volume de la solution (L)
ion dichromate : 16,6*
=
mmol
acide oxalique :
*0,1 = 6 mmol.
Le tableau d'avancement ne contient que les espèces permettant de résoudre le problème
Si l'ion dichromate est en défaut : 1,66-Xf=0 soit Xf=
mmol.
Si l'acide oxalique est en défaut : 6-
Xf=0 soit Xf=
mmol.
En conséquence l'ion dichromate est en
: Xf= 1,66 mmol.
concentration finale en ion chrome (III) ( mol/L) = quantité de matière (mmol) / volume total de la solution (mL)
volume total du mélange :
mL
[
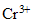
] = 2 Xf /200 = Xf/100 = 1,66 /100 = 1,66 10 exposant -2 mol/L
: Xf= 1,66 mmol.
concentration finale en ion chrome (III) ( mol/L) = quantité de matière (mmol) / volume total de la solution (mL)
volume total du mélange : mL
[
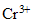
] = 2 Xf /200 = Xf/100 = 1,66 /100 = 1,66 10 exposant -2 mol/L