1. Quelles sont les formules semi-développées et les noms des composés organiques permettant d'obtenir l'ester E suivant :
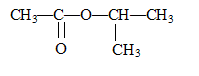
Ecrire l'équation de la réaction ; nommer l'ester ; donner les caractéristiques de cette transformation.
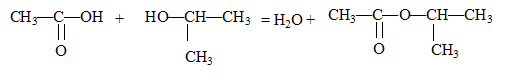
Nom de l'ester :
de 1-méthyléthyle ( ou acétate d'isopropyle)
La transformation est
, athermique, limitée par l'
de l'ester.
2. On étudie la cinétique de l'hydrolyse basique de l'ester E par suivi conductimétrique. On mélange rapidement dans un bécher n1=0,01 mol de soude et une quantité n2 d'ester en excès. Le volume V du mélange réactionnel est considéré comme constant. A 25°C on mesure la conductance du mélange toutes les 20 s.
| t (s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| G(mS) | 46,2 | 31,7 | 24,6 | 20,3 | 17,8 | 14,7 | 13 | 11,8 | 11,1 | 11 | 11 |
- Ecrire l'équation de la réaction associée à la transformation chimique étudiée.
Justifier qualitativement la diminution de la conductance.
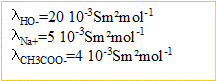
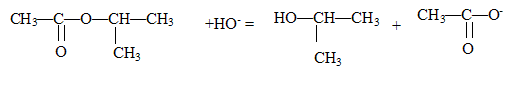
La conductivité due aux ion oxonium est négligeable, leur concentration étant très faible en milieu basique.
La concentration des ions sodium est
et ne contribue pas à la variation de la conductivité.
Du point de vue de la conductivité, on remplace les ions hydroxyde par des ion éthanoate de conductivité
fois plus petite.
La conductivité va donc diminuer. De plus conductance et conductivité sont
: donc la conductance diminue.
- Donner l'expression de la conductance initiale G0 en fonction de k, n1, V et des conductivités molaires ioniques. k : constante de la cellulle conductimétrique.
Initialement la solution contient des ions
et des ions
tels que :
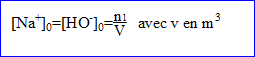
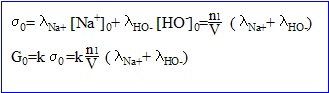
- Soit x l'avancement de la réaction. Donner l'expression de la conductance G à la date t en fonction de k, x, n1, V et des conductivités molaires ioniques.
n( ion sodium) =
mol ; n(ion hydroxyde) =
mol ; n(ion éthanoate) =
mol.
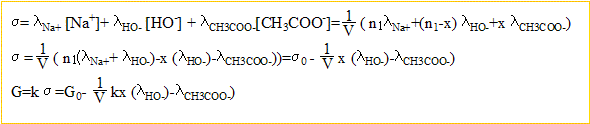
- Donner l'expression de la conductance Gf au bout d'un temps très long.
n( ion sodium) =n1 mol ; n(ion hydroxyde) =
mol ( en défaut) ; n(ion éthanoate) =
mol.
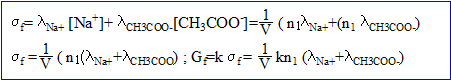
- Déduire des relations précédentes l'expression de x en fonction de n1, G0, Gf .
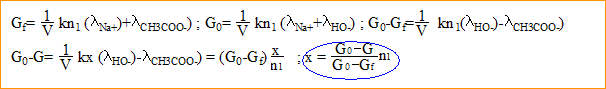
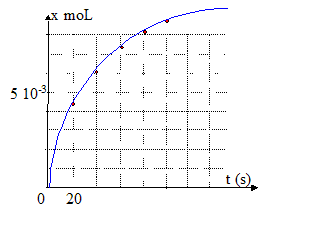
3. Donner la définition de la vitesse volumique de la réaction.
La vitesse volumique est égal à la
de l'avancement (mol) par rapport au temps divisée par le volume de la solution en litre.
Sur le graphe ci-dessus elle correspond au coefficient directeur de la
à la courbe.
- Comparer les vitesses volumiques au temps t=0 et t= 50 s d'après la courbe. Justifier.
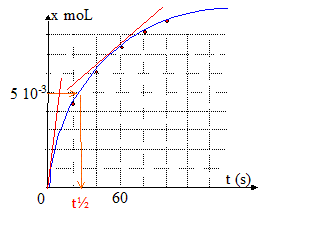
Le coefficient directeur de la tangente à t=0 est plus important que le coefficient directeur de la tangente à t= 50 s.
La vitesse de la réaction diminue au cours du temps car les
des réactifs diminuent.
- Définir le temps de demi-réaction t½ et le calculer.
temps au bout duquel l'avancement est égal à la moitié de l'avancement
soit 0,005 mol
Le graphe indique 25s.