|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
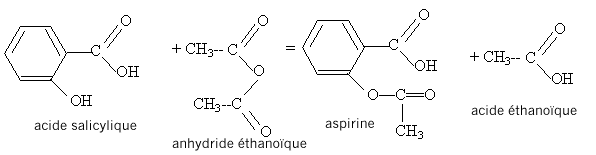
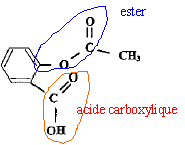
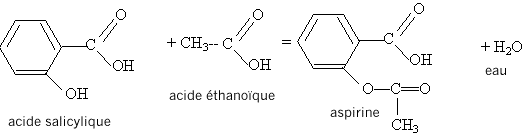
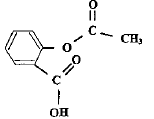 acide salycilique : acide salycilique :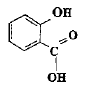
estérification, lente, athermique, limitée par l'hydrolyse de l'ester. Equation de la réaction modélisant cette transformation :
Tableau descriptif de l'évolution du système chimique :
Qr =[CH3CO2R][H2O] /([CH3CO2H][ROH]) =[x/(0,1-x)]2 Calcul de la valeur Qr,i dans l'état initial : Qr,i=[CH3CO2R]i [H2O]i /([CH3CO2H]i [ROH]i) or [CH3CO2R]i =[H2O]i =0 donc Qr,i=0. La constante d'équilibre K vaut 7,0 10-3 : Qr,i< K Le critère d'évolution spontanée indique une évolution du
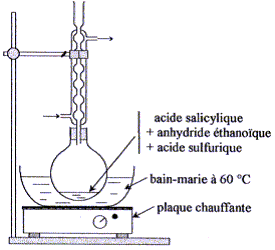
système dans le sens direct, de la gauche vers la droite. K= Qr éq =[CH3CO2R]éq [H2O]éq/([CH3CO2H]éq [ROH]éq) = (xf/(0,1-xf)2 Calcul de xf : (7 10-3)½ = = xf/(0,1-xf) 8,37 10-2 (0,1-xf) = xf soit xf = 7,7 10-3 mol. Taux d'avancement final t la transformation :t = xf/xmax avec xmax = 0,1 mol. t =7,7 10-3 / 0,1 = 7,7 10-2 (7,7 %). Type de montage : chauffage à reflux Rôle du réfrigérant à boules : condensation des vapeurs ; les espèces condensées retombent dans le milieu réactionnel ; on évite ainsi les pertes de matière. On chauffe le mélange réactionnel afin d'augmenter la vitesse de la réaction ; la température est un facteur cinétique. Rôle de l'acide sulfurique : catalyseur Il utiliser un ballon bien sec car l'anhydride éthanoïque réagit violemment avec l'eau pour conduire à l'acide éthanoïque ; de plus l'eau formé peut hydrolyser l'ester. Précautions à prendre pour introduire l'anhydride éthanoïque et l'acide sulfurique concentré dans le ballon : travail sous hotte , port de gants, blouse et lunettes, ces liquides étant corrosifs et nocifs. Quantités de matière initiales (mol) : Anhydride acétique : masse (g) = volume (mL) * masse volumique ( g/mL) = 12*1,08 = 12,96 g n(mol)= m/ Manh. =12,96 / 102 = 0,127 mol. acide salicylique : n(mol)= m/ Mac =10,0 / 138 = 7,25 10-2 mol. d'après les coefficients de la réaction, 7,25 10-2 mol d'acide salicylique réagit avec 7,25 10-2 mol d'anhydride éthanoïque pour former 7,25 10-2 mol d'aspirine. Or initialement il y a 0,127 mol d'anhydride acétique, valeur supérieure à 7,25 10-2 mol : donc ce réactif est en excès. Calcul de la masse théorique mth d'aspirine : mth = nMasp. =7,25 10-2 *180 = 13,0 g. Calcul du rendement de cette transformation : mexp /mth = *100 = 10,8/13*100 = 83,1 %.
|
|||||||||||||||||||||||||
| |
||||||||||||||||||||||||||
|
|