|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
|
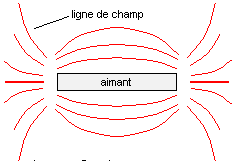
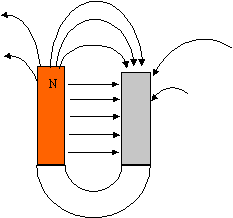
A- Champ magnétique crée par un aimant : On considère une aiguille aimantée. Indiquer son orientation lorsqu'elle est placée dans une zone ne contenant ni aimant, ni circuit électrique. L'aiguille aimantée
s'oriente dans le champ magnétique terrestre : l'extrémité qui pointe
vers le nord est appelé pole nord.
réponse : L'aiguille aimantée s'oriente dans le champ de l'aimant : deux pôles de même nom se repoussent ; deux pôles de nom contraire s'attirent.
aimant droit, aimant en U, limaille de fer, plaque de plexiglass transparente, rétroprojecteur. Les grains de limailles de fer se comporte comme de petites boussoles
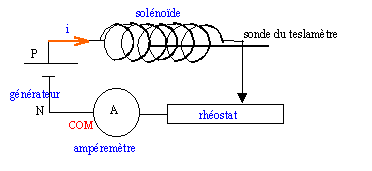
Décrire la constitution d'un solénoïde ; quelle est la différence entre une bobine et un solénoïde ? Bobine longue ( sa longueur est supérieure à 5 fois son diamètre) constituée de plusieurs couches de fil de cuivre enroulé sur un support. Dans la partie centrale du solénoïde le champ magnétique est uniforme ; ce dernier est nul l'extérieur du solénoïde. Une bobine peut avoir
une forme quelconque ( cas des moteurs électriques) ; le champ
magnétique crée n'est pas uniforme.
générateur de courant continu 12 V ( par exemple) ; intensité maximale : 10 A
teslamètre : sonde de mesure ( sonde de Hall ) reliée à un dispositif électronique avec afficheur de la valeur du champ ( mT)
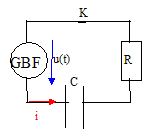
Les élèves doivent déterminer expérimentalement la
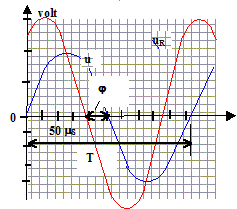
valeur de la capacité d'un condensateur par un montage simple. Indiquer sur le schéma ci-dessus les branchements de l'oscilloscope afin de visualiser u(t) sur la voie 1 et la tension aux bornes de la résistance uR sur la voie 2. 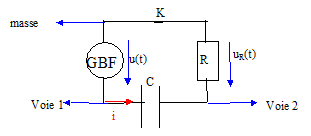
On obtient les oscillogrammes suivants :
Déterminer la période du signal délivré par le GBF, la fréquence, puis la pulsation. réponse :
période T : 255 ms = 2,55 10-4 s ; fréquence f= 1/T= 1/2,55 10-4 =3920 Hz ; pulsation w= 2pf = 2,46 104 rad/s
amplitude de u(t) = U = 2 V ( 2 divisions et 1V/div) ; amplitude de uR(t) = UR = 1,5 V ( 3 divisions et 0,5 V/ div) La tension aux bornes d'un résistor et l'intensité qui le traverse sont proportionnelles : I= U/R = 1,5/470 = 3,2 10-3 A.
Z = U/I =2/3,2 10-3 =627 W ; de plus : Z2 = R2 + 1/(Cw)2 ; 1/(Cw)2 = Z2- R2 =627²-470² = 1,4 105 ; 1/(Cw) =374 W d'où C= 1/(374*2,46 104)=
1,1 10-7 F.
réponse : i (t) est en avance sur u(t) cette avance correspond à environ 3 10-5 s ( lecture graphe); or T= 2,55 10-4 s ou encore 2 p radians par suite j = 2 p * 3 10-5 /2,55 10-4 = 0,73 rad. En remplaçant le condensateur par une bobine d'indictance L, la tension u(t) serait, cette fois, en avance sur l'intensité i(t).
Spectres (11pts): Comment obtenir le spectre de la lumière blanche sur un écran ? Décrire les principales caractèristiques du spectre obtenu. méthode 1 : placer dans l'ordre source de lumière blanche, prisme, lentille, écran méthode 2 : rétroprojecteur recouvert d'une feuiile moire possédant à son centre une fente de 1 cm de large et 10 cm de long ; placer un réseau sur la lentille supérieure ; observer sur un écran . Le spectre de la lumière blanche est continu : on y trouve toutes les couleurs de l'arc en ciel. Dans le cas du prisme, le bleu est le plus dévié ; dans le cas du réseau, le rouge est le plus dévié.
la solution diluée de parmanganate de potassium a une teinte rose violet : cette solution absorbe la couleur complémentaire du rose violet, c'est à dire la partie verte du spectre continu de la lumière blanche. Le spectre obtenu est un spectre de bandes d'absorption présentant une bande noire ( toute la partie centrale correspondant au vert est absente)
|
||||||||||||||||||||||||||||
|
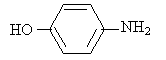
A- Synthèse du paracétamol : (32 pts) Les réactifs interenant dans cette synthèse sont le para-aminophénol et l'anhydride éthanoïque ( ou acétique). La réaction modélisant la transformation chimique peut être symboliquement écrite sous la forme : para-aminophénol + anhydride éthanoïque =paracétamol + acide éthanoïque. Données :
Protocole : 1- synthèse : à l'aide d'un entonnoir, verser 3,10 g de para-aminoiphénol dans un ballon posé sur un valet et ajouter 10 mL d'eau mesurés à l'aide d'une éprouvette. A l'aide d'une pipette graduée, ajouter 4,0 mL d'anhydride acétique ( introduite en excès) puis chauffer le mélange à reflux pendant 30 minutes. Au bout de 30 minutes, retirer le ballon en abaissant le support élévateur et refroidir le mélange dans un bain d'eau froide. Il apparaît alors un solide blanc. 2- Filtration sur buchner : Préparer un montage de filtration sous le vide de la trompe à eau et filtrer le solide sur le buchner. Laver le solide deux fois avec environ 5 mL d'eau froide. Laisser sécher pendant 5 minutes et récupérer le solide sur une coupelle. 3- Recristallisation du produit obtenu : Placer le paracétamol brut obtenu dans un erlenmeyer avec 40 mL d'eau et le chauffer jusqu'à ébullition. Mettre l'erlenmeyer dans un bain d'eau glacée. Attendre la recristallisation et filtrer sous vide le contenu de l'erlenmeyer. Placer les cristaux à 80°C dans une étuve. Questions : Nommer et entourer les groupes fonctionnels intervenant
dans la para-aminophénol. 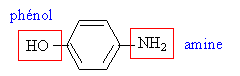
A quel changement d'état correspond la fusion d'un corps ? réponse : passage de l'état solide à l'état liquide.
réponse : la température de fusion d'un corps impur n'est pas constante. La température de
fusion d'un corps est d'autant plus élevée que les molécules sont
associées par liaisons hydrogène intramoléculaires.
réponse : C6H7ON
; M= 6*12+7+16+14 = 109 g/mol
réponse : port de lunette, blouse et gants ; travail
sous hotte ; utiliser une pipette surmontée d'un pipeteur.
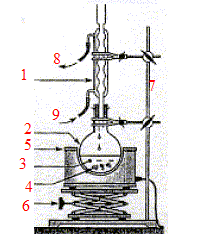
réponse : 1- réfrigérant droit à eau ; 2 -ballon ; 3- mélange réactionnel ; 4- pierre ponce ; 5- chauffe ballon ; 6- élévateur à croisillons ; 7- tige support ; 8- sortie de l'eau ; 9- arrivée de l'eau A quoi sert ce montage ? Quel est le rôle des pierres ponces ? Quel est le rôle du matériel n° 6 ? Ce montage à reflux permet d'accélérer la réaction en travaillant à température modérée ; il évite les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Les pierres ponces
régularisent l'ébullition ; l'élévateur à croisillons permet de monter
ou descendre le ballon ( chaud) sans se brûler.
réponse : pipette graduée voir éprouvette graduée.
Le lavage élimine les impuretés ; à froid le paracétamol est quasiment
insoluble dans l'eau.
réponse : la recristallisation est un procédé de purification. Dans le cas d'un
liquide , on aurait pu utiliser la distillation fractionnée. Le passage
à l'étuve élimine l'eau.( séchage)
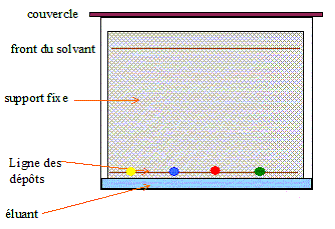
Dessiner et légender le schéma du montage expérimental à réaliser.
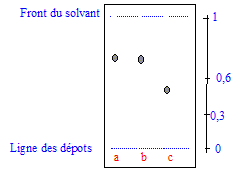
Donner l'allure du résultat observable sur la plaque de chromatographie si le pararcétamol fabriqué est considéré comme pur.
A et B ont le même rapport frontal dans un solvant donné : il s'agit du même produit pur. Quelle autre technique pourrait-on utiliser pour vérifier la pureté du paracétamol synthétisé ? réponse : :mesure du point de fusion sur un banc
Kofler.
|
|||||||||||||||||||||||||||||
|
1. Préparation des solutions : M ( KMnO4 )= 158 g/mol. On réalise une échelle de teinte à l'aide d'une solution aqueuse S0 de permanganate de potassium de concentration c0 = 1,0 10-3 mol/L. On utilise 6 tubes à essais d'une contenance 10 mL dans lesquels nous allons verser un volume précis de solution S0 afin d'obtenir des concentrations C de permanganate de potassium variant de 0 à 10-3 mol/L. Chaque tube sera compléter à 10 mL avec de l'eau distillée. Etablir la relation permettant de calculer les volumes VS0 de la solution S0 à prélever et VE d'eau distillée à ajouter à chaque tube afin de compléter le tableau ci-après. Quelle verrerie utilisée pour ces prélevements ? réponse : C=VS0c0 / (VS0+VE) =VS0c0 /10 avec VS0 en mL d'où VS0= 10 C/c0 et VE = 10 -VS0.
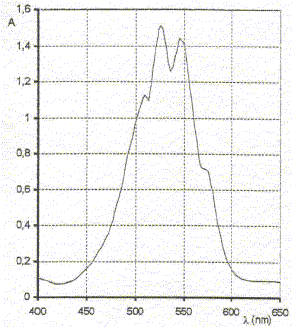
2. Loi de Beer-Lambert : Quelle propriété doit remplir une espèce chimique en solution aqueuse pour que l'on puisse déterminer sa concentration par spectrophotométrie ? réponse : espèce coloré présentant un maximum d'absorption pour sa couleur complémentaire. Une solution de permanganate de potassium rose violet présente un maximum d'absorption vers l= 530 nm.
Rappeler le protocol à suivre pour réaliser une mesure d'absorbance de la solution du tube 2 par exemple.( l étant fixée ) réponse : placer le tube à essai contenant uniquement le solvant ( n°1) faire le réglage du zéro du spectrophotomètre. Puis placer successivement les autres tubes et relever l'absorbance A. La courbe A= f( C) est une droite passant par l'origine de coefficient directeur k =2,2 103 L mol-1. En déduire une relation entre A et C. réponse : A= k C =2,22 103 C Un comprimé vendu en pharmacie contient du permanganate de potassium. On dissout le contenu d'un comprimé dans un volume V= 2,000 L d'eau distillée ; soit Sc la solution préparée. La mesure de l'absorbance donne A= 1,60. Déterminer la concentration molaire en permanganate de potassium de Sc. En déduire la quantité de matière n, puis la masse de permanganate de potassium contenu dans un comprimé. réponse : C= A/ 2,2 103 =1,6 / 2,22 103 =7,21 10-4 mol/L n (mol) = concnetration (mol/L) * volume de la solution (L) = 7,21 10-4 * 2 = 1,44 10-3 mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) =158 *1,44 10-3 =2,28 10-1 g. |
|||||||||||||||||||||||||||||
|
|
 R= 470 W.
R= 470 W.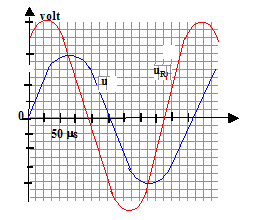 voie 1
: 1 V/div ; voie 2 : 0,5 V/div
voie 1
: 1 V/div ; voie 2 : 0,5 V/div