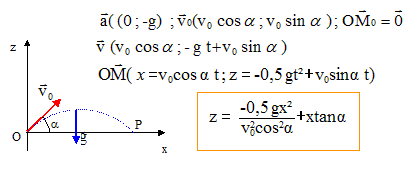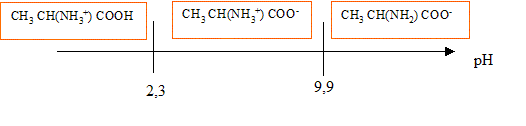|
Projectile; dipole LC, acide base, alanine, ammoniac, méthylamine d'après concours
controleur de la concurence et de la répression des fraudes 2004 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|||||||||||||||||||||
| .
. |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
Un homme étudie le mouvement d.un projectile de centre de gravité G et de masse m, dans un champ uniforme de pesanteur terrestre. Le sol est horizontal. Les forces de frottements sont considérées comme négligeables ainsi que la poussée d.Archimède. Soit un repère du référentiel terrestre tel que l'origine O coïncide avec la position du projectile à l'instant t = 0 du lancement. L'axe vertical orienté vers le haut et le plan (x O z) contient le vecteur vitesse initiale V0 qui fait un angle a avec l'axe horizontal. 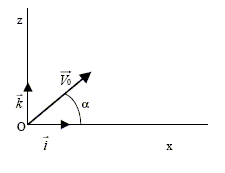
corrigé chute libre : la balle n'est soumise qu'à son poids, vertical, vers le bas, valeur mg. Ecrire la seconde loi de Newton la vitesse est une primitive de l'accélération ; la position est une primitive de la vitesse.
y=0 : le mouvement s'effectue dans le plan vertical défini par les vecteurs accélération et vitesse initiale. Sur l'axe Ox, la composante du vecteur vitesse est constante, égale à v0 cos a : le mouvement est uniforme sur l'axe Ox horizontal. En retombant sur le sol z = 0 soit : -0,5 g x² / (v0²cos²a) + x sin a /cos a =0 multiplier par cos a et diviser par x : -0,5 g x / (v0²cosa) + sin a =0 0,5 gx = v0²cosa sin a ; x = 2 v0²cosa sin a / g = v0² sin (2a) / g cette distance est maximale si sin (2a) = 1 soit a = 45°.
|
||||||||||||||||||||
|
Un condensateur de capacité C= 20 mF chargé sous une tension U= 5 V est branché aux bornes d'une bobine d'inductance L = 50 mH.
corrigé 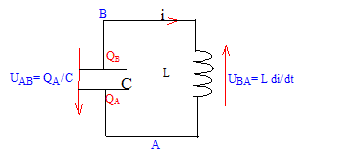
L'armature QA porte une charge négative ; QB= -QA. uc = UAB Les oscillations sont-elles libres ; aucun générateur n'est présent : ce dernier forcerait le circuit (LC)à osciller à la fréquence du générateur. UAB + UBA=0 ; QA/C + Ldi/dt = 0 ; i = dQA/dt ; di/dt =d²QA/dt² d'où : QA/C + Ld²QA/dt² = 0 soit : d²QA/dt² +QA/ (LC ) = 0 La pulsation propre w0 s'exprime en radian/seconde ; sa valeur est telle que w02 = 1/(LC) = 1/( 0,05*2 10-5) = 106. w0 = racine carrée (106) = 103 rad/s. période propre : T0 = 2p /w0 =6,28 / 103 =6,28 10-3 s. uc = U cos(w0 t ); QA = C UAB = C U cos(w0 t) dériver deux fois par rapport au temps : dQA /dt = -w0C U sin(w0 t) ; d²QA /dt² = -w²0C U cos(w0 t) ; repport dans l'équation différentielle : d²QA/dt² +QA/ (LC ) = 0 avec w02 = 1/(LC) -w²0C U cos(w0 t) + C U/ (LC) cos(w0 t) = 0 est vérifiée quelle que soit le temps Donc uc = U cos(w0 t ) représente la tension aux bornes du condensateur à t=0 le condensateur est chargé et la tension à ces bornes vaut : Umax = 5 V d'où uc = 5 cos(w0 t ) L'énergie initiale du dipole (LC) est stockée par le condensateur et vaut : E=½CU² = 0,5*20 10-6 *25 = 6,25 10-4 J Au cours du temps il y a échange d'énergie entre condensateur et bobine inductive. E= ½Li²(t) + ½Cu²c(t) Si la résistance du circuit est nulle, l'énergie se conserve. |
|||||||||||||||||||||
|
Données : N( Z=7) ; H (Z=1) ; masse atomique mlolaire (g/mol) : N : 14 ; H : 1. constante d'acidité : NH4+/NH3 : pKa = 9,2 ; CH3NH3+ / CH3NH2 : pKa = 10,75 ; alanine : pKa1 = 2,3 et pKa2 = 9,9.
corrigé configuration électronique de l’atome d’hydrogène : K1 de l’atome d’azote : K2L5. nature des liaisons dans la molécule d’ammoniac : covalente polarisée, l'atome d'azote attire à lui le doublet de liaison. géométrie de cette molécule : pyramide à base triangulaire, l'atome dazote est au sommet de la pyramide et porte un doublet non liant ( type AX3 Ed ans la méthode VSEPR) angle HNH : 107 °, inférieur à 109° car le doublet non liant repousse les trois doublets liants.
équation bilan de la réaction de dosage : NH3 + H3O+ = NH4+ + H2O à l'équivalence du dosage, les quantités de matière des réactifs sont en proportions stoéchiométriques : n(NH3) = 100 C ; n(H3O+) = 1,1*8 = 8,8 C= 8,8 / 100 = 8,80 10-2 mol/L nature de la solution à l’équivalence : chlorure d'ammonium NH4+ ; Cl-. le pH à l’équivalence : [H3O+]²= Ka C ; 2 log [H3O+] = log Ka + log C ; pH = ½(pKa-log C) pH= 0,5 (9,2-log (8,80 10-2 ) = 5,1. le pH à l'équivalence doit appartenir à la zone de virage de l'indicateur coloré : rouge de méthyle concentration de la solution commerciale de densité 0,88 et dont le pourcentage en masse d’ammoniac est de 32 % : masse de 1 L de solution : 880 g ; masse d'ammoniac pure : 880*0,32 =281,6 g masse molaire ammoniac : 14+3 = 17 g/mol concentration : 281,6 / 17 = 16,5 mol/L.
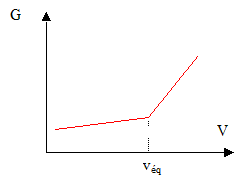
avant l'équivalence, dans l'erlenmeyer , l'acide est en défaut : les molécules d'ammoniac réagissent avec les ions oxonium ajoutés ; on ajoute des ions chlorure et il se forme des ions ammonium. Seuls les ions contribuent à la conductivité de la solution : tout se passe, du point de vue de la conductivité comme si on remplaçait des molécules NH3 par des ions NH4+ et Cl-. La conductivité de ces ions n'est pas très grande ( comparée à celle de l'ion oxonium) : la conductivité de la solution augmente lentement. Conductance et conductivité étant proportionnelles, la conductance augmente lentement. après l'équivalence, dans l'erlenmeyer , l'acide est en excès : on ajoute des ions H3O+ et Cl-. La conductivité de l'ion oxonium étant 5 fois plus grande que celle des ions Cl- et NH4+, la conductivité, donc la conductance augmente fortement.
|
|||||||||||||||||||||
|
On considère les deux composés, ammoniac et méthylamine.
corrigé formule semi développée de la molécule de méthylamine : CH3-NH2 amine primaire NH3 + H2O = NH4++HO-avec [NH4+]= [HO-] = 10-14/[H3O+] = 10-14/10-11,1 = 10-2,9 CH3-NH2 + H2O = CH3NH3+ + HO- avec [CH3NH3+]= [HO-] = 10-14/[H3O+] = 10-14/10-11,9 = 10-2,1 Ces molécules sont des bases : on observe l'apparition d'ion hydroxyde en solution. taux de protonation a = [NH4+] / C = 10-2,9/0,1 = 10-1,9 = 1,25 10-2 ( 1,25 %) a = [CH3NH3+] / C = 10-2,1/0,1 = 10-1,1 = 8 10-2 ( 8 %) Comparer la force du caractère acidobasique de ces deux composés : le taux de protonation est plus grand pour la méthylamine : celle ci est une base plus forte que l'ammoniac à concentration égale.
|
|||||||||||||||||||||
|
L’alanine a pour formule chimique CH3 CH(NH2) COOH. Ce composé existe à l’état solide et en solution aqueuse sous la forme d’un amphion ou ion dipolaire ou zwittérion de formule chimique CH3 CH(NH3+) COO-.
corrigé Dans la molécule d'alanine on trouve deux fonctions chimiques : une fonction amine -NH2 au caractère basique et une fonction acide carboxylique, au caractère acide. Base conjuguée de l’amphion : CH3 CH(NH2) COO- ; acide conjugué de l’amphion : CH3 CH(NH3+) COOH Les couples acide base sont : CH3 CH(NH3+) COOH / CH3 CH(NH3+) COO- pKa1 = 2,3 CH3 CH(NH3+) COO- / CH3 CH(NH2) COO- pKa2 = 9,9.
Lorsqu'on dissout de l'alanine dans l'eau, elle est essentiellement sous forme d'ion dipolaire -OOC-RCH-NH3+,( du fait de la forte solubilité dans l'eau) la concentration en molécules HOOC-RCH-NH2 est négligeable. HOOC-RCH-NH3+
+ H2O = -OOC-RCH-NH3+
+ H3O+ pKa1=
2,3 AH+ + H2O = A+ H3O+ ; Ka1 = [A] h / [AH+] = 10-2,3 = 0,005. A + H2O = A- + H3O+ ; Ka2 = [A-]h / [A]= 10-9,9 = 1,25 10-10 conservation A : [AH+]+[A]+[A-]=0,1 ; or A majoritaire dans l'eau : [A] voisin 0,1 mol/L solution électriquement neutre : h+ [AH+] = [OH-]+[A-] hypothèse : h et [OH-] négligeable devant [AH+] et [A-] alors [AH+] =[A-] Ka1 * Ka2 = h²[A-] / [AH+] = 6,25 10-13 h²= 6,25 10-13 ; pH= 6,1. si on calcule [AH+] et [A-] on trouve : [AH+] = [A] h/Ka1 = 0,1 * 10-6,1 / 0,005 = 1,6 10-5 alors que h= 7,8 10-7 [A-] =Ka2[A]/h= 1,25 10-10*0,1/ 10-6,1 = 1,6 10-5 ; hypothèse confirmée
|
|||||||||||||||||||||
|
|