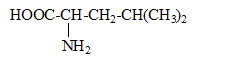|
d'après
concours technicien
chimiste Lille 2005
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
|
|
Sécurité
- nom formule - extraction - puissances de 10.
- Sous quelle forme se présente l'hydroxyde de sodium
dans le commerce, le plus souvent. Quelle(s) précaution(s) faut-il
prendre pour le manipuler ? Pourquoi ?
- Donner la signification des pictogrammes 1, 2, 4 .

- Attribuer à chacun des produits suivants le(s)
pictogramme(s) qui le concerne(nt) : soude, acide chlorhydrique.
- Quelles précautions doivent être prise pour manipuler une solution
d'acide chlorhydrique concentré ?
- Par mégarde, votre voisin casse le récipient précédent et reçoit des
projections sur la figure. Que faites vous ?
- Indiquer la formule chimique des composés chimiques
suivants :oxyde de titane IV, oxyde de fer II, sulfate de baryum
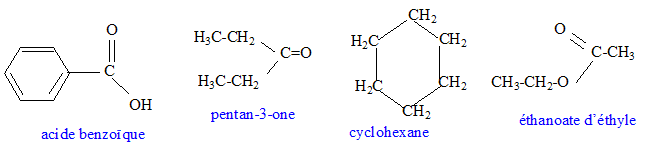
- Donner la formule semi-développées de : éthanoate d'éthyle,
pentan-3-one, cyclohexane, acide benzoïque.
- Donner les noms de : HNO3, KHCO3,
CH2=CHCl.
- Après avoir agité et laissé reposer un mélange d'eau
et d'hexane ( d=0,66) que voit-on ?
- Même question avec le mélange eau éthanol.
- Associer à chaque produit suivant le composé chimique
qu'il contient :
|
produit
|
composé chimique
|
|
parfum
|
acétone
|
|
dissolvant
|
carboxylate de sodium
|
|
teinture pour cheveux
|
eau oxygénée
|
|
savon
|
ester
|
- Ecrire la correspondance de puissance de 10 de :
microlitre, nanomètre, kilogramme, picoseconde, femtomole.
- Le pH d'une crème hydratante pour visage doit se
situer vers : 4, 7, 9, 12
corrigé
L'hydroxyde de sodium ( ou soude) se présente souvent sous forme de
pastilles solides, caustiques. Port d'une blouse,
de gants, et de lunettes si on travaille sur une solution concentrée.
Travailler sous hotte.
1 : substance toxique
; 2 : substance comburante ; 4 : dangereux pour l'environnement.
acide
chlorhydrique : corrosif ( pictogramme 3) provoque des
brûlures, irritant pour les voies respiratoires ( manipuler sous hotte,
port de blouse, gants et lunette)
En cas d'inhalation :
faire respirer de l'air frais et consulter un médecin.
En cas de contact
avec la peau : laver abondamment à l'eau.
En cas de contact
avec les yeux : rincer abondamment à l'eau , maintenir les paupières
écartées (10 minutes) et consulter un ophtalmologiste.
soude :
provoque de graves brulures, irritant. ( pictogramme 3)
oxyde de titane IV :
TiO2 ; oxyde de fer II : FeO ; sulfate de baryum
BaSO4.
HNO3 : acide nitrique ; KHCO3
: bicarbonate de potassium ou hydrogénocarbonate de potassium ; CH2=CHCl
: chlorure de vinyle
Après avoir agité et laissé reposer un mélange d'eau et
d'hexane ( d=0,66), liquides non miscibles, on voit deux phases
superposées : l'eau, la plus dense occupe la partie inférieure. Dans le
cas de l'eau et de l'éthanol, liquides miscibles, on distingue une
seule phase homogène.
|
produit
|
composé chimique
|
|
parfum
|
ester
|
|
dissolvant
|
acétone
|
|
teinture pour cheveux
|
eau oxygénée
|
|
savon
|
carboxylate de sodium
|
microlitre : 10-6 L; nanomètre : 10-9
m ; kilogramme : 103 g ; picoseconde : 10-12
s ; femtomole : 10-15 mol.
Le pH d'une crème hydratante pour visage doit se situer
vers 7.
|
|
radioactivité, acide
base,
- Indiquer si les affirmations suivantes sont vraies ou
fausses en justifiant :
- Le radium 22688Ra et
le radon 22686Rn sont
isotopes.
- La masse d'un noyau de radium est égale à la somme des masses de ses
nucléons.
- Le noyau de polonium 20884Po
est constitué de 84 neutrons et 124 protons.
- Parmi les couples acide base de l'eau quel est celui
( quels sont ceux) qui est ( sont) correctement écrit(s) ?
H2O / H3O+
; H3O+/ HO-
; H2O /HO- ; H3O+/
H2O ; HO- /H3O+.
- Pour chacune des questions suivantes indiquer si la
proposition formulée est exacte ou fausse :
a. Soit un monoacide de concentration c= 0,01 mol/L
- Si [H3O+] < c,
alors l'acide est faible.
- Si pH=2 alors l'acide est fort.
- Si pH=3, alors l'acide est totalement ionisé dans l'eau.
b. Soit une solution d'un acide HA dont le pKa
du couple HA/A- est 4,2.
- L'espèce A- prédomine à pH=6,2
- L'espèce AH prédomine à pH=5,5.
- Les espèces AH et A- sont en quantités égales
à pH=4,2.
- Vous êtes chargé de commander un produit. D'après les
indications presque identiques des catalogues de deux fournisseurs A et
B, lequel choisir :
A : 2,4 dichlorobenzoyl chloride 98%, d=1,49 ; 100 mL ; 32 euros
B : 2,4 dichlorobenzoyl chloride 98%, d=1,49 ; 100 g ; 26,6 euros.
- Vous devez ranger les produits suivants dans les
endroits appropriès parmi : armoire ventilée, armoire de sécurité,
dessicateur, réfrigérateur, placard général pour produits chimiques.
(un seul produit par endroit)
bromure de potassium KBr, cyanure de potassium KCN, peroxyle de
benzoyle C6H5-CO-O2-OC-C6H5,
chlorobenzène, éther diéthylique.
- La constante d'acidité de l'acide
monochloroéthanoïque ClCH2-COOH dans l'eau à
25°C est 1,4 10-3.
- Calculer le coefficient de dissociation a
et le pH des solutions de cet acide pour les concentrations suivantes :
10-5 ; 10-3; 0,1 mol/L.
- Comparer les valeurs des pH trouvées à celles de solutions d'acide
chorhydrique de mêmes concentrations.
- Calculer le pH d'une solution contenant 30 10-3
mol/L de benzoate de sodium C6H5COO-,
Na+.
C6H5COOH/C6H5COO-
: pKa = 4,7
corrigé
Le radium 22688Ra et le
radon 22686Rn ne sont
pas isotopes : deux isotopes ont le même numéro atomique ; ils
différent uniquement par leur nombre de neutrons.
La masse d'un noyau de radium est inférieure à la somme des masses de
ses nucléons : la différence de masse correspond à l'énergie de
liaisons des nucléons.
Le noyau de polonium 20884Po
est constitué de 84 protons et 208-84 = 124 neutrons.
H3O+/
H2O et H2O /HO-
sont corrects.
a.
Si [H3O+]
< c, alors l'acide est partiellement ionisé : acide faible.
Si pH=2 alors l'acide est totalement ionisé : l'acide est fort.
Si pH=3, alors [H3O+]
< c, l'acide est partielement ionisé dans l'eau.
b.
à pH>pKa, l'espèce A- prédomine
à pH<pKa, l'espèce AH prédomine.
à pH=pKa, les espèces AH et A-
sont en quantités égales.
A : masse de 100 mL : 1,49*100 =
149 g ; prix du gramme : 32/149 =0,215 euro/g.
B : prix du gramme :
26,6/100 = 0,266 euro/g. B est plus cher que A
bromure de potassium
KBr : placard général produits chimiques ; cyanure de potassium KCN :
poison donc armoire de sécurité ;
peroxyde de benzoyle C6H5-CO-O2-OC-C6H5
: conserver dans un endroit frais ( Risque d'explosion par le choc)
chlorobenzène : conserver à l'épreuve du feu à
l'intérieur d'un local ; séparer des substances réductrices, des
oxydants forts; conserver au froid.
éther diéthylique : très volatil, donc réfrigérateur, à
l'abri de la lumière. Séparer des oxydants forts.
AH + H2O = H3O+
+ A- avec Ka =[H3O+][A-]/[AH]
[H3O+]=[A-]
=aC et [AH] =(1-a)C d'où Ka =a2C / (1-a)
Ka
(1-a) =a2C ; a2+ Ka/Ca - Ka/C=0 ;
C= 10-5
mol/L : a2+140a
-140=0 donne a =0,993 ;[H3O+]
=9,93 10-6 mol/L et pH=5,0.
C= 10-3
mol/L : a2+1,4a
-1,4=0 donne a =0,674 ;[H3O+]
=6,74 10-4 mol/L et pH=3,17.
C= 10-1
mol/L : a2+1,4 10-2a -1,4 10-2 =0 donne a =0,111 ;[H3O+]
=1,11 10-2 mol/L et pH=1,95.
solutions d'acide chorhydrique de mêmes concentrations :
pH=5 ; pH=3 ; pH=1.
l'acide chlorhydrique est entierement ionisé ; l'acide
chloroéthanoïque est partiellement ionisé, sauf au très faibles
concentrations.
pH d'une solution
contenant 30 10-3 mol/L de benzoate de sodium C6H5COO-,
Na+.
C6H5COOH/C6H5COO-
: pKa = 4,7
la base A- réagit peu avec l'eau
donc [A- ] voisin de C.
solution électriquement neutre : [A-
] + [HO- ] = [Na+ ] + [H3O+]
; ce dernier étant négligeable en milieu basique
[A- ] + [HO-
] = [Na+ ] = C
conservation de A : [A- ] + [AH]=
C d'où [AH] = [HO- ] = Ke/
[H3O+]
Ka
= [A- ][H3O+]
/ [AH] s'écrit : Ka
= C[H3O+]2/
Ke soit : [H3O+]2=
KaKe/
C
2log [H3O+]
=log Ka
+logKe -log C ; pH = ½(pKe+pKa+log
C) = 0,5(14+4,7+log0,03)= 8,6.
|
|
titrage
acide base
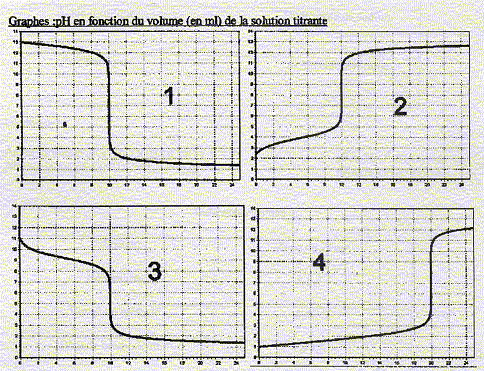
On réalise 4 titrages dont les graphes sont données
ci-dessous :
|
solution à titrer
|
solution titrante
|
|
hydroxyde de sodium
|
acide chlorhydrique
|
|
acide sulfurique
|
hydroxyde de sodium
|
|
acide formique
|
hydroxyde de sodium
|
|
ammoniaque
|
acide chlorhydrique
|
acide formique / ion formiate pKa =3,75 ; ion
ammonium/ammoniaque : pKa= 9,25.
|
indicateur coloré
|
zone de virage
|
|
hélianthine
|
3,1 ; 4,4
|
|
rouge de méthyle
|
4,4 ; 6,2
|
|
bleu de bromothymol
|
6 ; 7,6
|
|
phénolphataleine
|
8,2 ; 9,8
|
Donner la solution à titrer et titrante qui correspond à chaque graphe
ainsi que le(s) indicateur(s) coloré's) dans chaque cas. Justifier.
corrigé
La
solution titrante se trouve dans la burette, la solution à titrer dans
le becher.
graphe 1
: le becher contient une base, soude ou ammoniaque et la burette
l'acide chlorhydrique.
le pH du point
équivalent est proche de 7 et l'allure de la courbe au départ indique
l'hydroxyde de sodium.
la zone de virage de
l'indicateur coloré doit contenir le pH du point équivalent : donc bleu
de bromothymol
graphe 3
: le becher contient une base, soude ou ammoniaque et la burette
l'acide chlorhydrique.
le pH du point
équivalent est proche de 5,5 et l'allure de la courbe au départ indique
l'ammoniaque.
la zone de virage de
l'indicateur coloré doit contenir le pH du point équivalent : donc rouge
de méthyle
graphe 2
: le becher contient un acide, formique ou sulfurique et la burette
l'hydroxyde de sodium.
le pH du point
équivalent est proche de 8,5 et l'allure de la courbe au départ indique
l'acide formique.
la zone de virage de
l'indicateur coloré doit contenir le pH du point équivalent : donc phénolphataleine
graphe 4
: le becher contient un acide, formique ou sulfurique et la burette
l'hydroxyde de sodium.
le pH du point
équivalent est proche de 7 et le volume équivalent proche de 20 mL
indique un diacide, l'acide sulfurique.
la zone de virage de
l'indicateur coloré doit contenir le pH du point équivalent : donc bleu
de bromothymol
|
|
peroxyde
d'hydrogène
Le peroxyde d'hydrogène H2O2
en solution aqueuse se décompose lentement en eau et en dioxygène. La
décomposition est accélérée par divers facteurs.
- Donner deux utilisations du peroxyde d'hydrogène.
- Montrer que la réaction de décomposition est une
oxydo-réduction. Donner l'équation bilan.
Sachant que l'on appelle titre en volume, le volume de dioxygène,
mesuré dans les CNTP, que peut libérer un litre de solution de peroxyde
d'hydrogène selon l'équation de décomposition précédente :
- Calculer la concentration d'une solution de peroxyde
d'hydrogène à 10 volumes ( Vm=22,4 L/mol).
On se propose d'étudier la cinétique de la décomposition de peroxyde
d'hydrogène en présence d'un catalyseur, l'ion Fe2+.
Pour cela on prépare 8 béchers contenant V0=10
mL d'un solution de peroxyde d'hydrogène à la concentration C0
= 5,8 10-2 mol/L. L'ensemble est placé dans une
enceinte où la température est maintenue à 20 °C. A l'instant t=0, on
ajoute dans chaque bécher quelques gouttes d'une solution contenant
l'ion fer II. A l'instant t, on prend l'un des bechers et on y ajoute
une grande quantité d'eau glacée. On dose ensuite le peroxyde
d'hydrogène à l'aide d'une solution de permanganate de potassium à 0,01
mol/L, en milieu acide sulfurique. On note le volume versé pour obtenir
l'équivalence.
- Ecrire les demi-équations électroniques et l'équation
de la réaction de dosage.
- Quel est le rôle des ions Fe II ? Quel est le rôle
d'ajout d'eau glacé ? Quel changement de teinte observe-t-on dans le
becher à l'équivalence ? Expliciter.
- Un élève doit préparer 200 mL de solution de
permanganate de potassium à 0,01 mol/L à partir d'une solution mère,
notée S de concentration cS=0,1 mol/L. Pour cela
il prélève 10 mL de S à l'aide d'une pipette jaugée. Il les verse dans
un bécher et complète avec de l'eau distillée jusqu'à la graduation 200
mL. L'élève a commis deux erreurs. Lesquelles ? Justifier et comment
les corriger.
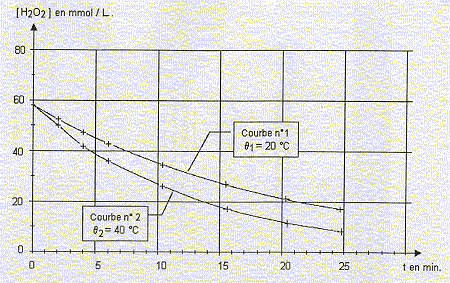
Le graphe ci-dessous représente la concentration en peroxyde d'hyrogène
restant à 20°C et à 40 °C en fonction du temps. On mesure la vitesse
instantanée de disparition du chlorure d'hydrogène à t1=
12 min et t2 = 20 min : 1,1 mmol L-1
min -1 et 1,6 mmol L-1
min -1 .
- Définir la vitesse instantanée de disparition du
chlorure d'hydrogène. Comment la détermine-t-on graphiquement ?
- Attribuer une date à chaque valeur de la vitesse. Justifier.
- Déterminer le temps de demi-réaction à 20°C et à 40°C. Conclure.
Données : H2O2/H2O
: E° = 1,77 V ; O2(g) /H2O2
: E° = 0,68 V ; MnO4-/Mn2+
: E°=1,51 V
ion fer II : vert ; ion fer III: brun ; ion permanganate
: violet ; ion manganèse II : incolore.
corrigé
le
peroxyde d'hydrogène est un oxydant, agent de blanchiment ; c'est aussi
un désinfectant ( eau oxygénée)
couple H2O2/H2O
: H2O2+2H++2e-
= 2H2O l'oxydant H2O2
se réduit.
couple O2(g) /H2O2
: H2O2 = O2(g)+2H++2e-
le réducteur H2O2 s'oxyde.
Bilan : 2H2O2
= 2H2O + O2(g)
concentration d'une solution de peroxyde
d'hydrogène à 10 volumes :
quantité de matière O2(mol) =
volume (L) / volume molaire (L/mol) = 10/22,4 =0,4464 mol
d'après les coefficients de l'équation ci-dessus, la
quantité de matière (mol) de peroxyde d'hydrogène est égale à deux fois
celle de dioxygène : 0,4464*2 = 0,89
mol dans 1 L.
2 fois {MnO4-
+ 8H++5e- = Mn2+
+ 4H2O }
5 fois { H2O2
= O2(g)+2H++2e-
}
2MnO4- + 6H++5 H2O2
= 5O2(g)+2 Mn2+ + 8H2O
équation de la réaction de dosage.
rôle des ions Fe II : catalyseur.
rôle d'ajout d'eau glacé : réalise un
blocage cinétique
changement de teinte observé dans le becher à
l'équivalence : avant l'équivalence l'ion permanganate est
en défaut; après l'équivalence cet ion est en excès. la couleur passe
de l'incolore au violet.
facteur de dilution = concentration
mère / concentration fille = 10
Prélever 20 mL de solution mère à la pipette jaugée et les
placer dans une
fiole jaugée
de 200 mL; puis ajouter de l'eau distillée jusqu'au trait de jauge.
vitesse instantanée de disparition du chlorure
d'hydrogène : v = - d[H2O2]/dt
avec V : volume de la
solution et x : avancement de la réaction (mol)
On la détermine
graphiquement en traçant la tangente à la courbe ci-dessus à la date
considérée; puis on détermine le coefficient directeur de cette
tangente. La vitesse est égale à la valeur absolue de ce coefficient.
Au cours du temps la
tangente se rapproche de l'horizontale : le coefficient directeur, en
valeur absolue, diminue. La vitesse diminue donc 1,1 mmol
L-1 min -1 correspond à t2 = 20
min.
temps de
demi réaction : durée au bout de laquelle l'avancement est
égal à la moitié de l'avancement final. ( ou la moitié de l'avancement
maximal si la réaction est totale)
Tracer une
horizontale à partir de 40 mmol/L :
l'intersection avec
la courbe 1 donne t½ = 7,5 min à 20°C
l'intersection avec
la courbe 2 donne t½ = 4,5 min à 40°C
Conclusion
: la température est un facteur cinétique qui augmente la vitesse de la
réaction .
|
|
acide
bromhydrique + alcène
L'addition d'acide bromhydrique sur un alcène conduit à
la formation d'un dérivé monobromé de masse molaire M= 137 g/mol.
- Déterminer la formule brute de ce composé monobromé.
- Quels sont les différents isomères de constitution
possibles ? Donner pour chacun d'eux la formule semi-développée et leur
nom.
- L'un des isomères, noté A1
possède un carbone asymétrique. Quel type d'isomérie présente-t-il ?
Représenter les deux stéréoisomères.
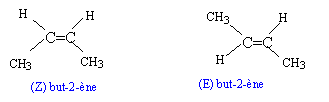
- Donner la structure de(s) alcène(s) conduisant à A1.
Indiquer leur configuration s'il y a lieu. C: 12 ; H : 1; br : 80 g/mol.
corrigé
formule
brute de ce composé monobromé : Cn H2n+1Br
M= 12 n + 2n+1+80 = 137 soit n = 4
BrCH2-CH2-CH2-CH3
1-bromobutane
CH3-CHBr-CH2-CH3
2-bromobutane
(CH3)2CH-CH2Br
1-bromo-2-méthylpropane
(CH3)2CBr-CH3
2-bromo-2-méthylpropane
CH3-CHBr-CH2-CH3
: le carbone n°2 est asymétrique ( carbone tétragonal porteur de 4
groupes différents) on observe l'isomérie optique.
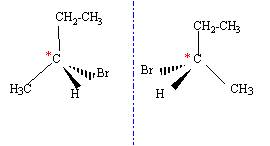
structure de(s) alcène(s) conduisant à
A1 : l'alcène est linéaire
but-1-ène CH2=CH-CH2-CH3
|
|
Leucine
On considère la molécule de leucine.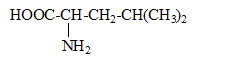
- Quelle est la famille de ce composé ? Donner son nom
en nomenclature systématique.
- Ce composé possède deux couples acido-basique dont
les pKa sont pKa1 = 2,36
et pKa2 = 9,6
- Ecrire les couples acide base correspondants.
- Représenter la forme majoritaire à pH=1 et à pH=11.
- Sous quelle forme majoritaire se trouve la leucine à pH=7.
corrigé
famille
de ce composé : acide aminé ; acide
2-amino-4-méthylpentanoïque.
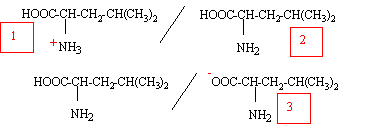
à pH=1 valeur
inférieure à pKa1, la forme (1) prédomine ;
à pH=11, valeur
supérieure à pKa2, la forme (3) prédomine ;
à pH=7, la forme (2)
prédomine.
|
|
retour
-menu
|