|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Données : peroxodisulfate de potassium
K2S2O8 ; M= 270,3 g/mol ; F
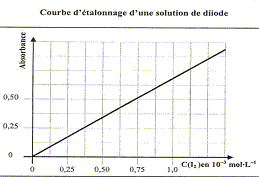
: 100°C Courbe d'étalonnage d'une solution de diiode :
On prendra RT/F lnx= 0,060 log(x) L'utilisation d'une méthode spectrophotométrique est liée à la présence d'une espèce chimique colorée dans les réactifs ou dans les produits de la réaction. Ici c'est l'ion triiodure qui donne sa coloration brune à la solution.
corrigé significations des pictogrammes figurant sur l'étiquette du peroxodisulfate de potassium : substance comburante, irritante, nocive. préparation de la solution : balance précision, capsule de pesée, spatule, fiole jaugée 100 mL, entonoir, pissette eau distillée. Quantité de matière (mol)= volume (L) * concentration (mol/L) = 0,1*2,5 10-3 = 2,5 10-4 mol masse (g) = masse molaire (g/mol) * quantité de matière (mol )= 270,3 * 2,5 10-4 =0,068 g peser cette masse de solide, dissoudre dans un peu d'eau
distillée, placer dans une fiole jaugée de 100
mL, rincer le becher, compléter la fiole
jaugée jusqu'au trait de jauge ; agiter pour rendre
homogène.
Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). e est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe. Absorbance et concentration étant proportionnelles, cette relation peut être utilisée pour réaliser des dosages ou des suivis cinétiques principe d'un spectrophotomètre : Un spectrophotomètre est constitué : o d'une partie optique: source, monochromateur à réseau, cuve à échantillon o d'une partie électronique: photodiode, chaîne de traitement du signal et affichage de l'absorbance. Le spectrophotomètre mesure l’absorbance d’une solution pour différentes longueurs d’ondes. Un rayon d’une longueur d’onde choisie traverse une cuve contenant la solution à étudier. Les molécules de la solution absorbent plus ou moins le rayon lumineux, on définit alors l’absorbance pour cette longueur d’onde. mode opératoire permettant d'obtenir la courbe d'étalonnage du diiode en solution. rechercher la longueur d'onde correspondant au maximum d'absorption du diiode. Pour cette longueur d'onde, régler le 0 % d'absorbance du spectrophotomètre sur le solvant, l'eau. Faire une gamme de teintes ( solution de concentrations connues) et mesurer pour chaque solution l'absorbance. Tracer la courbe A= f(C) et déterminer le coefficient directeur de la droite. Dans notre cas on trouve pour ce coefficient k= 0,5/0,75
10-3= 667 L mol-1 soit
A= 667 C.
2I- = I2+ 2e- S2O82-+ 2e-= 2SO42- 2I- + S2O82- = I2+2SO42- concentration en diiode à la date t = 75 min : A= 0,85 d'où C= 0,85/667 = 1,27 10-3 mol/L
La concentration finale du diiode est pratiquement égale à la concentration maximale : la transformation est totale. temps de demi-réaction ordre de grandeur : durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final xfin = xmax = 2,5 10-5 mol et Afin = 0,85. Absorbance et concentration étant proportionnelles
: A(t½)= 0,43 d'où t½
voisin de 9 min ( lecture sur
le tableau) E= E°(S2O82-/SO42-) -E°(I2/I-) =2,01-0,62 = 1,39 V lnK= nFE/(RT) avec n = 2 (2I- = I2+ 2e-) et RT/F lnx= 0,060 log(x) log K= E/0,03 = 1,39 /0,03 = 46,3 ; K de l'ordre de 1047.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
corrigé 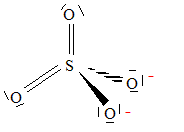
degré ou nombre d'oxydation du soufre dans cet ion : n(S) + 4*(-2) = -2 soit n(S) = +VI L'ion peroxodisulfate en solution aqueuse réagit
avec l'eau. Equation de cette réaction / H2O = ½O2+2H++2e- S2O82-+H2O = ½O2+2H+ +2SO42- temps au bout duquel la concentration en ion peroxodisulfate dans la solution aura-telle varié de 1% : dx/dt = k(a-x) avec a : concentration initiale et x: avancement volumique. dx/(a-x) =kdt ; intégrer : ln(a-x) =-kt + Cte on détermine la constante d'intégration par les conditions initiales : à t=0 , Cte= ln a d'où ln( a-x) - ln a = -kt soit ln [a/(a-x)] = kt. x/a = 0,01 ; ln(1/0,99) = 7,5 10-7 t ; t = 1,34 104 min = 9,3 jours. cette solution peut être utilisée quelques jours après sa préparation.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Données :
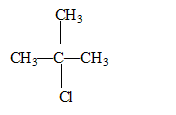
2-chloro-2-méthylpropane
C4H9Cl On travaille avec 2,0 mL de solution de 2-chloro-2-méthylpropane dans 75 mL d'un mélange eau/éthanol à environ 50% en volume. L'ensemble est maintenu à une température de 40°C.
corrigé conditions de stockage : produit volatil, inflammable. Stockage dans une armoire ventilée située dans un endroit frais. précautions à prendre lors de son utilisation : éviter toute présence de flamme, local ventilé formule
semi-développée du
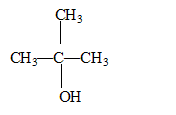
2-chloro-2-méthylpropane : un carbone asymétrique doit être tétragonal et relié à 4 substituants différents : donc pas de carbone de ce type dans cette molécule. formule semi-développée, le nom et la classe de l'alcool produit par hydrolyse du 2-chloro-2-méthylpropane : 2-méthylpropan-2-ol, alcool
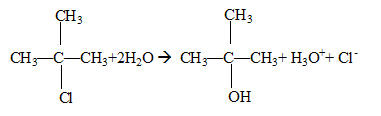
tertiaire : équation de la réaction d'hydrolyse :
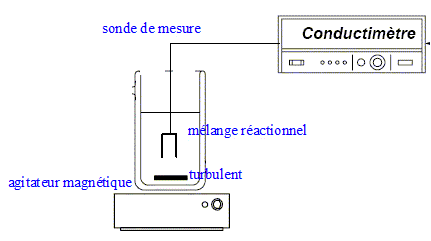
principe de la conductimétrie : La conductance d’une solution est proportionnelle aux concentrations des ions ( aux faibles concentrations). La conductimétrie, mesure de la conductance ou de la conductivité, permet de déterminer des concentrations. Le suivi de cette réaction peut se faire par cette méthode cinétique car parmi les produits apparaissent deux ions ; ces derniers contribuent à la conductivité de la solution. il est nécessaire d'étalonner le conductimètre : réglage de la température ( la conductivité dépend de la température) et connaitre la constante de cellule ou caractéristiques de la sonde de mesure donnée par le constructeur. Le fabricant de conductimétres fournit une table de la conductivité d’une solution de chlorure de potassium à 0,1 mol/L pour toutes les températures allant de 15,0 et 30,0°C. Mesurer la conductance de cette solution de chlorure de potassium et la température de la solution ; cette table permet de déterminer la constante de la cellule utilisée. Un potentiométre d’étalonnage permet d’ajuster la valeur lue.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|


 ; M= 92,57 g/mol ; d=0,84 à 20°C; E :
51°C
; M= 92,57 g/mol ; d=0,84 à 20°C; E :
51°C