A. On dissout 1,78 g d'acide lactique ( CH3-CHOH-COOH ) dans 200 mL d'eau. Le pH vaut pH=2,45.
1. Ecrire l'équation de la réaction de l'acide lactique sur l'eau.
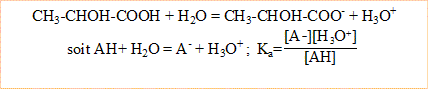
2. Calculer :
- La concentration des espèces prèsentent en solution.
- Le pKa puis la constante d'acidité Ka du couple acide base.
- Le pourcentage de molécules d'acide lactique dissociées.
Les ions oxonium, lactate et les molécules d'acide lactique sont présentes en solution. L'ion hydroxyde est très en milieu acide.
[ion oxonium]= 10^-pH = 10^-2,45 = 10^-3 mol/L
La solution est électriquement : [ion lactate]=[ion oxonium]
Masse molaire acide lactique : M= 3*12+6+3*16 = 90 g/mol
Quantité de matière (mol) = masse(g) par la masse molaire (g/mol)
n(acide lactique) = 1,78/90 = 1,93 10^-2 mol
concentration en soluté apporté (mol/L) = quantité de matière (mol) par le volume de la solution (L) = 1,93 10^-2 / 0,2 = 9,67 10^-2 mol/L
Conservation de l'élément carbone : [ion lactate]+[acide lactique]=9,67 10^-2
[acide lactique]= 9,67 10^-2 - 3,55 10^-3= 10^-2 mol/L
Constante d'acidité Ka = (3,55 10^-3)² / 9,31 10^-2 = 1,35 10^-4
pKa = -log Ka = -log (1,35 10^-4) = 3,87.
Pourcentage de molécules d'acide lactique dissociées : 3,55 10^-3 / 9,67 10^-2 *100 = 3,67 %
B. On dissout 1,47g de cyanure de sodium dans 300 mL d'eau. Le pH de la solution vaut pH=11,15
1. Ecrire l'équation de la réaction de l'ion cyanure sur l'eau.
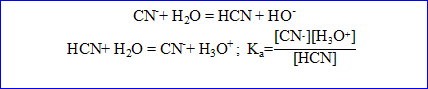
2. Calculer:
- La concentration des espèces présentes dans la solution.
- Le pKa et constante d'acidité Ka du couple acide base.
- Le pourcentage d'ion cyanure ayant fixé un proton.
Les ions hydroxyde, cyanure et les molécules d'acide cyanydrique sont présentes en solution. L'ion est très minoritaire en milieu basique.
[ion oxonium]= 10^-pH= 10^-11,15 = 7,08 10^-12 mol/L
Produit ionique de l'eau : [ion hydroxyde] [ion oxonium]= 10^-14 à 25°C.
D'où : [ion hydroxyde]= 10^-14 / 7,08 10^-12 = 10^-3 mol/L
La solution est électriquement neutre : [ion hydroxyde] + [ion cyanure]=[ion sodium] = 0,1 mol/L (1)
Masse molaire cyanure de sodium : M= 12+14+23 = 49 g/mol
Quantité de matière (mol) = masse(g) / masse molaire (g/mol) = 1,47/49 = 3,0 10^-2 mol/L
Concentration en soluté apporté (mol/L) = quantité de matière (mol) / volume de la solution (L) = 0,03 / 0,3 = 0,10 mol/L
Conservation de l'élément carbone : [acide cyanhydrique]+[ion cyanure]=0,10 (2)
Les relations (1) et (2) donnent : [ion hydroxyde] = [acide cyanhydrique]
(2) donne : [ion cyanure] = 0,1- 1,41 10^-3 = 10^-2 mol/L
Constante d'acidité Ka = 9,86 10^-2* 7,08 10^-12 / 1,41 10^-3 = 4,95 10^-10
pKa = -log Ka = -log (4,95 10^-10) = 9,3.
Pourcentage de molécules d'acide cyanhydrique formées : 1,41 10^-3 / 0,1 *100 = 1,4 %
C. Le chlorure d'ammonium NH4Cl se dissout avec l'eau .
1. Ecrire l'équation de sa dissolution dans l'eau.
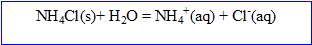
2. On dissout m g de chlorure d'ammonium dans V = 100 mL d'eau distillée. Le pH de cette solution vaut pH= 5,7.
- L'ion ammonium appartient au couple ion ammonium /ammoniac ( pKa = 9,2). Quelle forme prédomine dans cette solution ?
à pH < pKa la forme prédomine ( ion ammonium)
- Ecrire l'équation de la réaction de l'ion ammonium avec l'eau ; exprimer la constante d'acidité Ka.
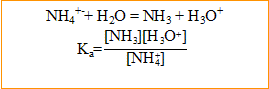
- Déterminer les concentrations des espèces présentes à l'équilibre. En deduire la concentration Co en soluté apporté.
[ion oxonium]= 10^-pH= 10^-5,7 = 2,0 10^-6 mol/L
La solution est électriquement neutre : [ion oxonium] + [ion ammonium]=[ion chlorure] = Co (1)
Conservation de l'élément azote : [ammoniac]+[ion ammonium]=Co (2)
Les relations (1) et (2) donnent : [ammoniac]= [ion oxonium]
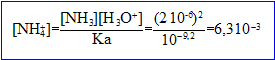
Co= 6,3 10^-3 + 2 10^-6 = 6,3 10^-3 mol/L
- Calculer m, masse de chlorure d'ammonium dissoute M = 53,5 g/mol
Quantité de matière (mol) = concentration (mol/L) volume de la solution (L)
n= 6,3 10^-3 * 0,1 = 6,3 10^ -4 mol
Masse (g) = quantité de matière (mol) fois masse molaire (g/mol)
m= 6,3 10^-4 *53,5= 0,034 g