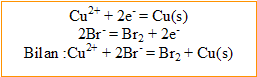1. Ecrire l’équation de la réaction d’oxydoréduction entre les ions bromure et les ions cuivre (II) . Préciser ques sont le réducteur et l'oxydant. La constante d’équilibre associée vaut : K = 8,2 10^-26. Donner l'expression de cette constante.
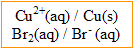
L'ion cuivre (II), l' se réduit.
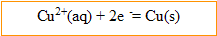
L'ion bromure, le s'oxyde.
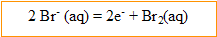
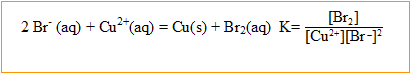
2. Une solution S est obtenue en mélangeant :
- V1 = 20,0 mL de solution de bromure de cuivre (II) : C1 = 5,0 10^-2 mol/L en soluté apporté,
- V2 = 20,0 mL de solution de dibrome Br2 : C2 = 2,5 10^-3 mol/L en soluté apporté.
Quelle est l'évolution spontanée du système si on ajoute du cuivre solise ?
[ion cuivre II]= C1V1/(V1+V2)= 20*0,05 / 40 = 0,025 mol/L
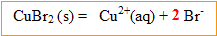
[ion bromure ]= 2*[ion cuivre II]= 0,05 mol/L
[dibrome]= 20 * 0,0025/40 = 0,00125 mol/L
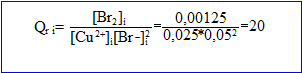
Le quotient de réaction initial est à la constante K : le système évolue spontanément en sens , de la droite vers la gauche.
3.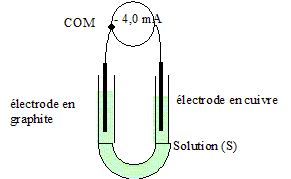
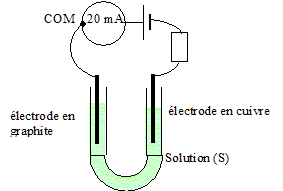
- Le système évolue-t-il spontanément ?
- Quel le sens de déplacement des électrons dans l’ampèremètre et des ions dans la solution ?
- Ecrire les équations des réactions qui ont lieu aux électrodes.
- Quel est la durée de fonctionnement de ce système ? ( le cuivre est en excès)
Le système est une dans laquelle une réaction spontanée a lieu ( pas de contrainte imposée par un générateur).
L'ampéremètre indiquant une valeur négative, il est branché à l'envers : le sens conventionel du courant va de la borne COM vers de l'électrode de cuivre : les électrons se déplacent, dans le circuit extérieur, dans le sens , du cuivre ( borne de la pile) vers l'électrode de graphite ( borne de la pile).
En solution les ions négatifs se déplacent vers le cuivre ; les ions positifs se déplacent dans le sens du courant vers l'électrode de graphite.
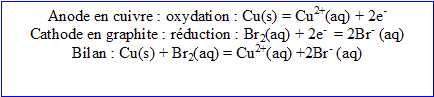
La pile s'arrête de fonctionner si :
- l'équilibre est atteint
- si l'un des réactifs a disparu. (Le dibrome est en défaut)
Quantité de matière de dibrome : n(Br2 )= C2 V2 = 0,0025 * 0,020 = 5 10^ -5 mol
Quantité de matière d'électrons (n(e) = 2 n(Br2) = 10^ -4 mol
Quantité d'électricité mise en jeu : Q= 96500 n(e) = 9,65 C
Or Q(coulomb) = I(ampère) * durée (seconde)
I= 9,65 / 4 10^-3 = 10^ 3 s.
4. 
- Comment fonctionne se dispositif ? L'évolution est-elle spontanée ?
- Quelles sont les réactions aux électrodes ? Quel est le bilan ?
Le dispositif fonctionne en : il s'agit d'une réaction .
L'énergie électrique fournie par le générateur est en partie convertie en énergie chimique.
Le cuivre rélié à la borne négative du générateur est une cathode : réduction des ions cuivre II
Le graphite relié à la borne positive du générateur joue le rôle d'anode : oxydation des ions bromure.