|
CAPES physique chimie ( d'après concours 2006) autour du zinc : hydroxyde, électrolyse En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||
| .
. |
||
|
||
|
|
Produit de solubilité : Zn(OH)2(s) pKs1=17,2 ; Zn(OH)2(s) + 2H2O(liq) = Zn(OH)42- + 2H+ pKs2=29,5. potentiel standart à
pH=0 : masse volumique du zinc r = 7,14 103 kg m-3
Zn(OH)2 (s) + 2H+ = Zn2+ + 2H2O (liq) : se comporte comme une base Zn(OH)2(s) + 2H2O(liq) = Zn(OH)42- + 2H+ : se comporte comme un acide Solubilité de l'hydroxyde de zinc dans l'eau
pure : - En fonction de la concentration en ion hydrogène [H+] : d'une part : Zn(OH)2(s) = Zn2+ + 2HO- Ks1=[Zn2+][HO-]2 = [Zn2+]Ke2 / [H+]2 soit [Zn2+]= Ks1[H+]2 / Ke2 = 10-17,2 / 10-28 [H+]2 =1010,8 [H+]2 d'autre part : Zn(OH)2(s) + 2H2O(liq) = Zn(OH)42- + 2H+ pKs2=29,5. Ks2=[Zn(OH)42- ][H+]2 soit [Zn(OH)42- ] = Ks2/[H+]2= 10-29,5/[H+]2 s = [Zn2+] + [Zn(OH)42-] = 1010,8
[H+]2+ 10-29,5/[H+]2 dériver : ds/d[H+] = 2 1010,8 [H+] -2 10-29,5/[H+]3 cette dérivée
s'annule pour [H+]4 = 10-29,5/1010,8
soit [H+] =10-10 ; pH=10.
Le précipité d'hydroxyde de zinc apparaît dès que [Zn2+][OH-]2=10-17,2. A ce moment [Zn2+] =10-3 molL-1 et [OH-]=racine carrée( 10-17,2/10-3) = 7,94 10-8 mol L-1. pH = 14 + log( 7,94 10-8 )= 6,9. Le précipité d'hydroxyde de zinc disparaît dès que tous les ions Zn2+ sont engagés dans le complexe [Zn(OH)4] 2- c'est à dire [Zn(OH)4] 2- =10-3 mol L-1. Ks2=[Zn(OH)42-
][H+]2
; [H+]2
= 10-29,5/10-3
= 10-26,5 ; [H+]= 10-13,25
; pH= 13,2.
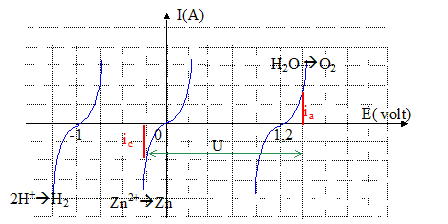
Les réactions électrochimiques possibles lors de cette électrolyse, à chaque électrode : cathode négative, réduction de l'eau, de H+ avec formation de H2 : 2H+ + 2e- = H2(g) réduction de Zn2+ : Zn2++ 2e- =Zn(s) anode positive , oxydation de l'eau : H2O = ½O2(g) + 2H+ + 2e- Sachant que sur l'aluminium la surtension de réduction de l'ion H+ est de l'ordre de -1 V et que la surtension de réduction de l'ion zinc (II) est très faible, on justifie l'emploi du métal aluminium pour former la cathode. Lors d'une électrolyse on appelle surtension la différence entre la tension en l'absence de courant et la tension en présence du courant. Pendant l'électrolyse, au voisinage de la cathode les cations disparaîssent ( réduction de ces derniers ) : leur concentration diminue fortement au contact de l'électrode. La loi de Nernst s'appliquant, le potentiel de l'électrode diminue. L'électrolyse ne peut se poursuivre avec une vitesse acceptable, qu'en augmentant la tension appliquée entre les électrodes : c'est ce que signifie surtension. La réduction sera d'autant plus facile que la surtension
est plus faible ( c'est le cas de Zn2+ )
A l'équilibre les intensités anodique et cathodique sont égales: il suffit de repèrer sur le graphe l'endroit où ces intensités sont égales, ce qui donne la différence de potentiel entre les couples redox. Allure des courbes intensité-potentiel correspondant aux différentes réctions envisagées :
si U est grand ( U>3 V), en plus des réactions
précédentes, on observe la réduction de H+. Le courant cathodique présente un palier de diffusion : la hauteur du palier de diffusion est proportionnelle à la concentration de l'ion zinc (II). Des ions Zn2+ disparaissent par
réduction, d'autres migrent du sein de la solution vers l'électrode :
un équilibre s'établit. Quantité d'électricité : Q(C)= I(A)Dt(s)= 96500 n avec n : quantité de matière (mol) d'électrons. n = IDt / 96500 = 115000*24*3600 / 96500 =1,03 105 mol or Zn2+ + 2e- = Zn(s) d'où n(Zn) = ½ n(e-) =5,15 104 mol masse de zinc (g) = masse molaire (g/mol) * quantité de matière (mol) m=65,4*5,15 104 =3,36 106 g = 3,36 103 kg. volume (m3) = masse (kg) / masse volumique ( kg m-3) = 3,36 103 / 7,14 103 =0,47 m3. épaisseur (m) =
volume (m3) / surface (m²) =0,47 /3,2 =0,15 m.
|
|
|
|
||
|
|