|
Synthèse du benzoate d'éthyle ( chimie organique ) En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
||
| .
. |
||
|
||
|
|
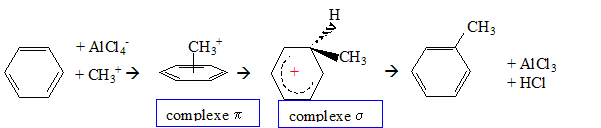
A partir du benzène, réaction de substitution aromatique ( Friedel et Crafts) : le catalyseur est le chlorure d'aluminium AlCl3, acide de Lewis. AlCl3 + CH3-Cl = AlCl4- + CH3+.
En présence de lumière UV, le dichlore conduit par rupture de la liaison Cl-Cl aux radicaux Cl2 = 2 Cl.. Une réaction de type radicalaire conduit à C6H5-CH2Cl
C6H5-CH2Cl
+ HO- --> C6H5-CH2OH
+ Cl-
3 fois {F-CH2OH + H2O = F-COOH + 4H+ + 4e- } oxydation de l'alcool 2 fois { Cr2O72- + 14H+ + 6e- = 2 Cr3+ + 7H2O } réduction du dichromate 3F-CH2OH
+ 2Cr2O72-
+ 16H+ = 3F-COOH
+ 4Cr3+ + 11H2O
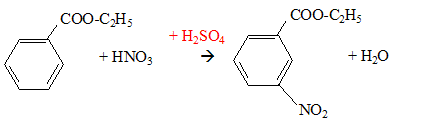
F-COOH + CH3-CH2OH(
étahnol) = F-COO-CH2CH3
+ H2O
|
|
|
|