|
Titre alcalimétrique d'une eau minérale TA, TAC : diagramme prédominance, équivalence d'un titrage bac S Polynésie 09/04 |
||||
|
||||
|
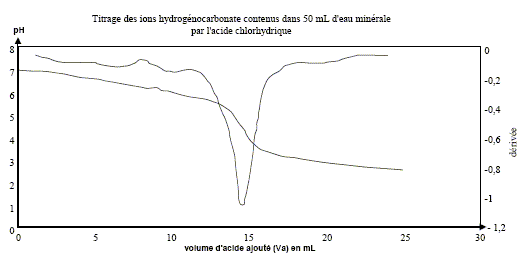
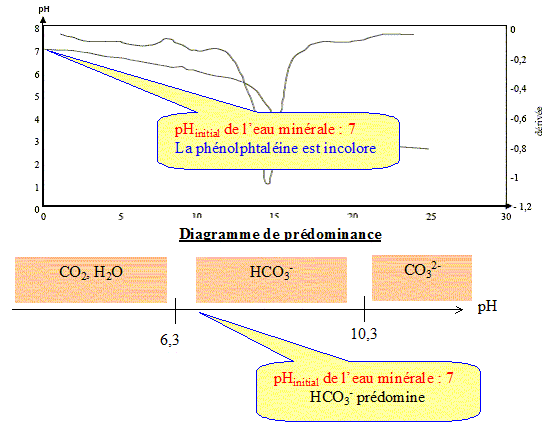
Les eaux minérales contiennent de nombreuses espèces chimiques dissoutes. Ces eux minérales sont particulièrement riches en ions " bicarbonate ". Ce nom désigne en fait les ions hydrogénocarbonate HCO3-(aq). Valeurs de quelques pKa de couples acido-basiques : couple (CO2, H2O / HCO3- ) : pKa1 = 6,3 Pour le couple (HCO3- / CO32-) : pKa2 = 10,3 On prélève V1 = 50,0 mL d'eau minérale que l'on titre par une solution d'acide chlorhydrique de concentration Ca= 2,0 10-2 mol.L-1. Un système d'acquisition permet de mesurer le pH au cours du dosage. On obtient ainsi la courbe donnant le pH en fonction de Va, volume d'acide versé, et celle de sa dérivée dpH/dVa = f(Va).
Le titre alcalimétrique TA : La mesure du titre alcalimétrique TA permet de déterminer la concentration en ions carbonate CO32- (aq). On donne la définition du TA : c'est le volume, exprimé en millilitres, de solution d'acide chlorhydrique de concentration Ca = 2,0 10-2 mol.L-1 en ions H3O+(aq) nécessaires pour doser les ions carbonate CO32- (aq) dans 100 mL d'eau minérale en présence de phénolphtaléine. La zone de virage de cet indicateur coloré est : incolore [ 8 ; 10 ] rose
Par ajout d'acide chlorhydrique, le pH de l'eau minérale diminue. Or la phénolphtaléine change de couleur à pH supérieur à 8 : cet indicateur reste donc incolore et on ne pas observer un volume équivalent. La valeur du TA de cette eau minérale est nulle : cette eau contient très peu d'ion ions carbonate CO32- (aq).
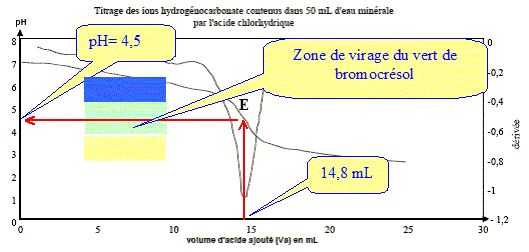
Le titre alcalimétrique complet TAC : Le titre alcalimétrique complet TAC est lié à la concentration totale en ions hydrogénocarbonate HCO3-(aq) et carbonate CO32- (aq). On donne la définition du TAC : c'est le volume, exprimé en millilitres, de solution d'acide chlorhydrique de concentration Ca = 2,0 10-2 mol.L-1 nécessaires pour doser 100 mL d'eau minérale en présence de vert de bromocrésol dont la zone de virage est : jaune [3,8 ( vert) 5,4 ] bleu
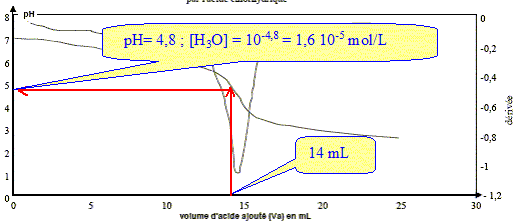
Equation de la réaction utilisée pour le titrage : HCO3- (aq) + H3O+(aq) = CO2 (aq) + 2 H2O(l) Quantité na d'ions H3O+(aq) introduite lorsque Va = 14,0 mL : na = VaCa = 14 10-3 * 2,0 10-2 = 2,8 10-4 mol. Quantité d'ions H3O+(aq) restant dans le volume total du mélange réactionnel :
n'a =[H3O+](V1+Va) =1,6 10-5 ( 50 +14) 10-3 = 1,0 10-6 mol. Justifions l'utilisation de cette réaction pour réaliser un dosage. La réaction support du dosage doit être rapide et totale. C'est à dire que l'avancement final xfin doit être égal à l'avancement maximal xmax. xmax = na = 2,8 10-4 mol. xfin =na -n'a = 2,8 10-4- 1,0 10-6 =2,8 10-4 mol xfin est très proche de xmax : la réaction est totale.
Le choix du vert de bromocrésol comme indicateur coloré est judicieux : le pH du point équivalent appartient à la zone de virage de cet indicateur. Concentration molaire C des ions hydrogénocarbonate dans cette eau minérale : A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. V1[HCO3- ] = Va E Ca ; [HCO3- ] = Va E Ca / V1 [HCO3- ] =14,8* 2,0 10-2 / 50 = 5,9 10-3 mol/L. Concentration massique T des ions hydrogénocarbonate dans cette eau minérale : masse molaire HCO3- : M= 1+12+3*16 = 61 g/mol. T = [HCO3- ] M = 5,9 10-3 * 61 = 0,36 g/L. TAC de cette eau minérale : "volume, exprimé en millilitres, de solution d'acide chlorhydrique de concentration Ca = 2,0 10-2 mol.L-1 nécessaires pour doser 100 mL d'eau minérale en présence de vert de bromocrésol " 14,8 mL d'acide pour doser 50 mL d'eau minérale 14,8*2 = 29,6 ( 29 mL) d'acide pour doser 100 mL d'eau minérale. |
||||
|
|
||||
|
|