|
bac S Polynésie 2007 : à propos du lait, tensioactifs, acide lactique.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
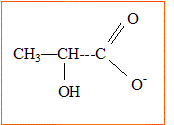
Extrait de : les secrets de la casserole, H. THis, Ed. Belin. Données : Le lactose est le sucre caractéristique du lait. Sous l'action d'enzymes, le lactose se transforme en acide lactique au cours du temps, augmentant l'acidité naturelle du lait. Acide lactique : CH3-CHOH-COOH ; masse molaire M=90 g/mol. Le pKa du couple acido-basique de l'acide lactique est égal à 3,8. On notera AH l'acide lactique. Etude du document :
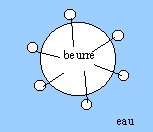
" du beurre fondu et de l'eau restent séparés" "séparés" signifie : espèces qui ne se mélangent pas. D'où en langage scientifique : le beurre fondu et l'eau sont deux liquides non miscibles. La partie soluble dans l'eau des molécules tensioactives est qualifiée par l'adjectif " hydrophile " ( amie de l'eau ). Schéma d'un globule de matière grasse en suspension dans l'eau : -------------------O longue chaine carbonée lipophile, hydrophobe ; tête hydrophile
L'acide lactique :
Formule semi-développée de l'ion lactate, base conjuguée de l'acide lactique : CH3-CHOH-COO-. Expression de la constante d'acidité Ka du couple acide lactique / ion lactate, noté AH / A- : AH (aq) +H2O = A- (aq) + H3O+(aq). Ka = [A-(aq) ]éq[H3O+(aq)]éq / [AH (aq) ]éq. Concentration en ion oxonium de la solution : [H3O+(aq)]éq = 10-pH = 10-2,9 = 1,3 10-3 mol/L. Taux d'avancement t de la réaction de l'acide lactique avec l'eau. Le tableau ci-dessous est établi pour un volume de solution V= 1 L.
t =10-2,9 / 10-2 = 10-0,9 ; t = 0,13. Le taux d'avancement final étant très inférieur à 1, la réaction de l'acide lactique avec l'eau est limitée. Valeur de la constante Ka du couple de l'acide lactique : [A-(aq) ]éq= [H3O+(aq)]éq =10-pH = 10-2,9 = 1,258 10-3 mol/L La conservation de l'élément carbone s'écrit : [A-(aq) ]éq+[AH (aq) ]éq = c = 10-2 mol/L [AH (aq) ]éq =10-2 -1,258 10-3 =8,74 10-3 mlol/L Ka = [A-(aq) ]éq[H3O+(aq)]éq / [AH (aq) ]éq. Ka = 1,258 10-3* 1,258 10-3 / 8,74 10-3 ; Ka = 1,8 10-4. pKa = - log Ka = - log 1,81 10-4 ; pKa = 3,7. L'écart avec la valeur indiquée (3,8) est sans doute due à une mesure imprécise du pH.
Dosage de l'acide lactique dans un lait : On introduit dans un erlenmeyer vA=20,0 mL d'un échantillon de lait et quelques gouttes de phénolphtalèine. On ajoute progressivement une solution d'hydroxyde de sodium de concentration cb= 5,0 10-2 mol/L. Le changement de couleur du milieu réactionnel est observé pour un volume de solution d'hydroxyde de sodium ajouté égal à 9,2 mL.
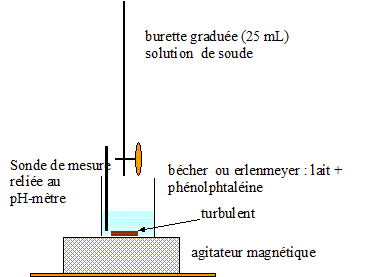
Equation de la réaction entre l'acide lactique et l'ion hydroxyde HO-. AH (aq)+ HO- (aq) = H2O + A-(aq) Concentration molaire de l'acide lactique du lait étudié. A l'équivalence les quantité de matière des réactifs mis en présence sont en proportions stoechiométriques cvA = cB véqui ; c= cB véqui / vA =9,2* 0,05/20 ; c = 2,3 10-2 mol/L. titre massique d'acide lactique (g/L) = concentration (mol/L) * masse molaire (g/mol) t = 0,023*90 =2,1 g/L. Cette valeur étant supérieure à la norme (1,8 g/L), le lait n'est pas frais. |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
|