|
thermodynamique :étude d'un cycle moteur à 4 temps type Diesel BTS travaux publics 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
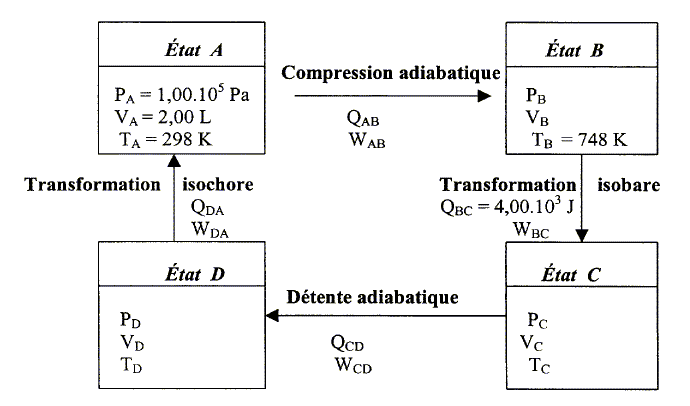
Le travail et la chaleur échangés au cours de ces transformations supposées réversibles sont notés respectivement W et Q. Le système est considéré comme fermé. Le mélange air combustible est assimilé à un gaz parfait. Le schéma suivant résume l'ensemble des transformations et des états :
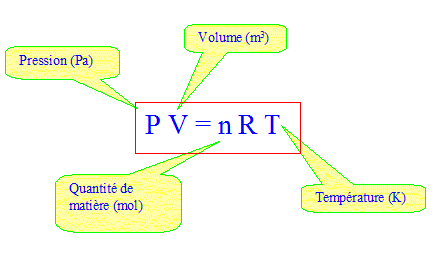
Données : R= 8,31 J K-1 mol-1 ; PVg = P'V'g et P1-gTg= P'1-gT'g avec g = 1,40. capacité calorifique molaire à volume constant cV= 20,8 J mol-1 K-1. capacité calorifique molaire à pression constante cP= 29,1 J mol-1 K-1. Que signifie système fermé ? réponse : La quantité de matière "air combustible" est constante mais échanges d'énergie et de travail avec l'extérieur. Calculer le nombre de moles n de gaz qui participent à ce cycle. équation des gaz parfaits :
n= PV/(RT) = 1,00 105 * 2,00 10-3 /(8,31*298) =8,08 10-2 mol. ( valeur plus précise conservée pour la suite des calculs 8,076 10-2) Calculer pour chaque état les valeurs de pression, volume et température : réponse : Etat B : La compression A-->B est adiabatique et on connaît P = 1,00 105 Pa, T= 298 K ( état A) et T' = 748 K (état B) P1-gTg= P'1-gT'g avec g = 1,40. P' = P[T / T']g / (1-g) P'= 1,00 105 [298 / 748]1,4 / (-0,4) =1,00 105 *0,398-3,5 ; PB= 25,1 105 Pa. Equation des gaz parfaits en B : VB PB= nRTB d'où VB= nRTB / PB=8,076 10-2*8,31*748 / 25,1 105 ; VB= 2,00 10-4 m3.
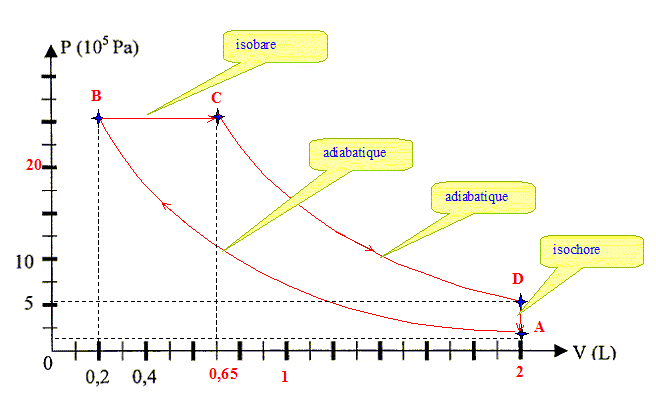
Etat C : La compression B-->C est isobare et on connaît PB = 25,1 105 Pa. PB= PC= 25,1 105 Pa. La chaleur échangée lors d'une transformation isobare vaut Q = nCpDT= nCp(TC-TB) avec Q = 4,00 103 J ; CP= 29,1 J mol-1 K-1 ; n = 8,076 10-2 mol TC-TB = Q /( nCp) =4,00 103/( 8,076 10-2 *29,1) =1,702 103 K TC=TB +1,702 103 =748+1702 ; TC=2,45 103 K. Equation des gaz parfaits en C : VC PC= nRTC d'où VC= nRTC / PC=8,076 10-2*8,31*2,45 103 / 25,1 105 ; VC= 6,55 10-4 m3. Etat D : La détente C-->D est adiabatique ; la transformation D-->A est isochore et on connaît VA = 2,00 10-3 m3: d'oùVD=VA=2,00 10-3 m3. adiabatique : PCVCg= PDVDg avec g = 1,40. PD = PC[VC / VD]g PD = 25,1 105 [6,55 10-4/ 2 10-3]1,4 ; PD= 5,26 105 Pa. Equation des gaz parfaits en D : VD PD= nRTD d'où TD = VD PD / (nR)=2,00 10-3* 5,26 105/(8,076 10-2 *8,31) ; TD= 1,57 103 K. Tracer le diagramme de Clapeyron, préciser son sens :
Calculer la quantité de chaleur QDA échangée entre les états D et A : La transformation étant isochore, il n'y a pas de travail. La variation d'énergie interne est égale à la quantité de chaleur échangée QDA. La variation d'énergie interne d'un gaz parfait ne dépend que de la différence de température DU = ncVDT =nCV(TA-TD) DU = QDA = 8,076 10-2*20,8 (298-1,57 103)=-2,14 103 J. En déduire le travail total échangé W et commenter : La variation d'énergie interne est nulle au cours du cycle : Qtotal + Wtotal = 0 La quantité de chaleur échangée au cours d'une transformation adiabatique est nulle : QAB=QCD=0 QDA = -2,14 103 J ; QBC= 4,00 103 J Wtotal = - Qtotal = -QBC-QDA = (4,00-2,14) 103 = -1,86 103 J. Le signe moins traduit le fait que le travail est fournit par le système au milieu extérieur : il s'agit d'un moteur. |
|||||||
|
|
|||||||
|
|