|
Aide laboratoire ( d'après concours Versailles 2006) électricité, cyclohexane, concentration et dilution, sécurité. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||
| .
. |
||||||||||
|
||||||||||
|
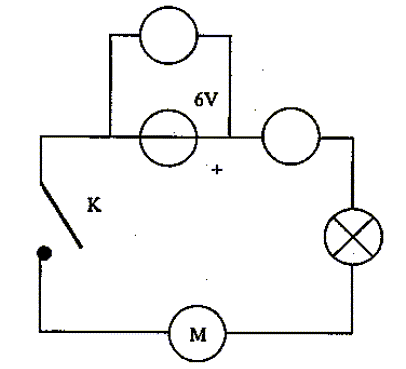
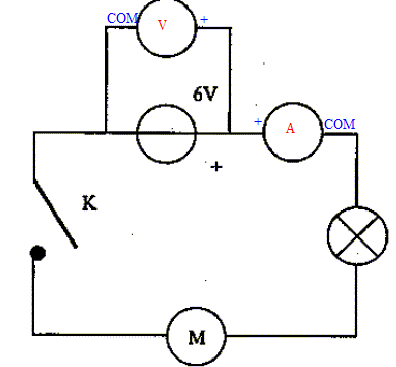
Un professeur vous demande de sortir le matériel nécessaire pour réaliser le montage suivant : 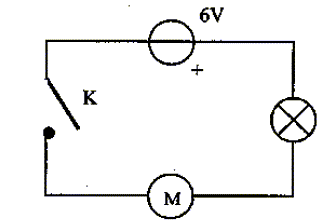
corrigé la liste du matériel : générateur de tension continue 6V ; moteur ; lampe ; interrupteur et fils. Les deux bornes à utiliser
pour mesurer l'intensité du courant : COM et mA. Les deux bornes à utiliser
pour mesurer la tension aux bornes du
générateur : V et COM
Le calibre le plus approprié pour mesurer la tension aux bornes du générateur : 20 V, supérieur à 6 V et le plus proche. On constate que la lampe ne brille
pas et que le moteur ne tourne pas. Les causes possibles de
ce dysfonctionnement sont : On mesure la valeur de la
résistance de la lampe à l'aide d'un
ohmmètre et on lit : 1. ( si la lampe n'est pas grillée : on lit " quelques ohms") |
||||||||||
|
||||||||||
|
On dispose d'une solution dont l'étiquette est reproduite ci-dessous : 
corrigé Signification des pictogrammes : inflammable, irritant, nocif, danger pour l'environnement. Six précautions à prendre pour manipuler ce produit : absence de flammes, travail sous hotte, port de blouse, lunettes et gants, récupérer après utilisation. Formule chimique de ce produit : C6H12. Masse molaire de ce produit : 84,16 g/mol. Densité de ce produit : d= 0,778.
|
||||||||||
|
Pour réaliser une
échelle de teintes, on fabrique une solution
S0 de sulfate de cuivre et plusieurs solution
filles S1, S2,
S3.
corrigé On souhaite préparer un volume V= 1,00 L de la solution aqueuse S0 de sulfate de cuivre. Formule du sulfate de cuivre pentahydraté CuSO4, 5 H2O.Masse molaire M= 249,6 g/mol. Compléter les phrases suivantes : La masse de sulfate de cuivre pentahydraté à utiliser est : m= c0 V M = 0,10*1,00*249,6=24,96 g ( la balance est précise au centième de gramme près ) On introduit cette masse m de sulfate de cuivre pentahydraté dans une fiole jaugée de volume V= 1,00 L. On ajoute environ 500 ml d'eau distillée et on agite. On complète ensuite jusqu'au trait de jauge. On a réalisé une solution par dissolution d'un solide.. La couleur de la solution est bleue. Choisir le matériel nécessaire pour préparer 250 mL de S1 à partir de S0 : facteur de dilution F=c0/c1 = 0,1/0,01 = 10 volume de la fiole jaugée : 250 mL ; volume de la pipette jaugée 250/F=250/10 = 25,0 mL ; pipeteur et pissette d'eau distillée. Rayer la mauvaise
proposition : On souhaite préparer une solution S de concentration molaire c=0,50 mol/L. On ne peut pas utiliser S0, car cette solution est moins concentrée que la solution S à préparer. A partir de S0, par dilution, on obtient des solutions moins concentrées.
|
||||||||||
|
|