|
concours aide technique
spectrophotomètre,
conductimètre, dosage pHmétrique .
Creteil
2003
|
||||||||||||||||||||
|
||||||||||||||||||||
|
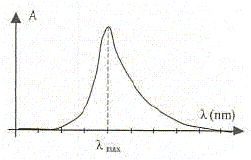
Afin de tracer le spectre d'absorbance du sulfate de cuivre on utilise un spectrophotomètre. L'allure du spectre est donné ci-dessous :
- Que désigne l
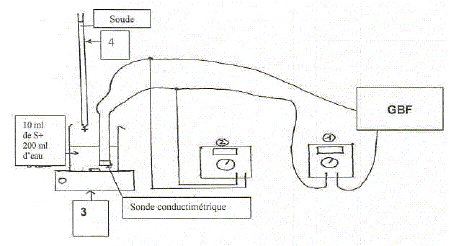
? - Décrire des opérations à réaliser pour mesuere l'absorbance du sulfate de cuivre en solution. - Rechercher pour quelle longueur d'onde la solution de sulfate de cuivre présente un maximum d'absorption. Se placer à cette longueur d'onde, et faire le "zéro" en plaçant le solvant, eau distillée dans la cuve. Toujours à cette longueur d'onde, placer les différentes solutions de sulfate de cuivre dans la cuve et mesurer l'absorbance. Dosage conductimétrique d'une solution de sulfate de cuivre . Le GBF délivre une tension sinusoïdale de valeur efficace 3 V et de fréquence 2000 Hz. L'intensité du courant atteint au maximum 15 mA. Le professeur désire : - utiliser une solution d'hydroxyde de sodium de concentration cB=4,00 10-2 mol/L - prélever et verser dans le becher 10,0 mL d'une solution de sulfate de cuivre déja préparée. - prélever et verser dans le becher 200 mL d'eau.
Quelle est la formule de l'hydroxyde de sodium ( soude) et celle du sulfate de cuivre ? hydroxyde de sodium NaOH ; sulfate de cuivre CuSO4. Quelle verrerie prévoir pour prélever 10,0 mL et 200 mL ? 200 mL sont mesurés avec une éprouvette graduée ; 10,0 mL sont prélevés avec une pipette jaugée. Les instruments 1 et 2 sont des multimètres. Quelle grandeur mesure l'instrument 1 ( unité, bornes à choisir, calibre) ? Multimètre, fonction ampèremètre monté en série : mesure de l'intensité en milliampère ( bornes COM et mA du multimètre , calibre 20 mA par exemple) Quelle grandeur mesure l'instrument 1 ( unité, bornes à choisir, calibre) ? Multimètre, fonction voltmètre monté en dérivation : mesure d'une tension ( volt) ( bornes COM et V du multimètre , calibre 10 V par exemple) Nommer les appareils 3 et 4. Appareil n°3 : agitateur magnétique ; appareil n°4 : burette graduée.
Dosage pHmétrique d'une solution d'acide éthanoïque : Le professeur dérire utiliser : - La solution précédente d'hydroxyde de sodium (soude) : cb=4,00 10-2 mol/L - une solution SA d'acide éthanoïque : cA= 7,0 10-2 mol/L Le laboratoire dispose d'une solution S1 d'acide éthanoïque à 80 %. Cette solution a une densité d= 1,05. La masse molaire de l'acide éthanoïque est M=60,0 g/mol. Déterminer le volume de la solution S1 à prélever pour préparer VA=2,00 L de SA. Quantité de matière (mol) = volume (L) * concentration (mol/L) = VA CA =2*7 10-2 = 0,14 mol Solution S1 : masse d'acide pur dans 1 L : m= 1,05*0,8 = 0,84 kg = 840 g. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 840 / 60 = 14 mol. Volume à prélever : 0,14/14 = 0,010 L = 10,0 mL. Quelles précautions particulière doit-on prendre ? Travail avec blouse, gants et lunette de sécurité. Que doit-on mettre à disposition du professeur pour effectuer les réglages préalables éventuels du pHmètre ? Thermomètre ; deux solutions tampons étalons à pH = 7 et pH= 4 par exemple. Au laboratoire : Quel est le symbole du sodium ? Na. Comment se présente le sodium au laboratoire ? solide gris conservé dans de l'huile. Quelles précautions faut-il prendre pour le manipuler ? Travail en milieu anhydre. Compléter les tableaux :
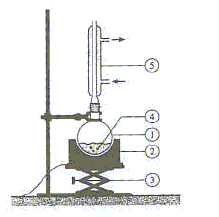
Comment s'appele le montage suivant ? Quel est son intérêt ? :
Chauffage à reflux : Il permet d'accélérer la vitesse de la réaction, tout en évitant les pertes de matière. Les vapeurs se condensent dans le réfrigérant à eau et retombent dans le milieu réactionnel. 1 : ballon ; 2 : chauffe ballon ; 3 : élévateur à croisillons ; 4 : milieu réactionnel ( pierre ponce + réactifs) ; 5 : réfrigérant à eau.
|
||||||||||||||||||||
|
|
||||||||||||||||||||
|
|