|
chimie : dosage par substitution ; réactions prépondérantes ; potentiométrie ; concours Agrégation interne 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||
| .
. |
||||||||
|
||||||||
|
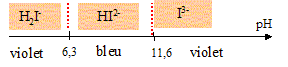
Complexométrie, dosage par substitution : On souhaite doser une solution de nitrate de calcium. Le mode opératoire est le suivant : Placer la solution de sel dissodique de l'éthylènediamminetétracétique ( noté EDTA) de concentration CEDTA=0,0504 mol/L dans une burette au 1/20 de mL. Dans un becher verser une prise d'essai de V1 = 20,00 mL de la solution de nitrate de calcium, 10 mL de tampon ammoniacal de pH=9,5, 10 gouttes de solution d'ion [MgY]2-, 0,1 g ( une pointe de spatule ) de NET dans NaCl. Le NET est en défaut par rapport à [MgY]2-. Verser la solution d'EDTA jusqu'à l'équivalence. Soit Véq =10,4 mL, le volume équivalent. Procéder à deux dosages concordant. Le dosage a une précision évaluée à 1%. NET : Noir Eriochrome T, triacide dont une partie du diagramme de prédominance est le suivant :
Ligand I3- du NET
:
Ce sont les réactions (entre les espèces initialement majoritaires ) possédant les constantes d'équilibre les plus grandes. Avant ajout EDTA et avant ajout de NET : [MgY]2- + Ca2+ = [CaY]2- + Mg2+ (0) K0=[[CaY]2-][Mg2+] / ([[MgY]2- ][Ca2+]) or Ca2+ +H2Y2- = [CaY]2- + 2H+(1) Kf1=[[CaY]2- ][ H+]2 / ([Ca2+][H2Y2-] )= 1010,7. et Mg2+ +H2Y2- = [MgY]2- + 2H+(2) Kf2=[[MgY]2- ][ H+]2 / ([Mg2+][H2Y2-] )= 108,7 (1)-(2) donne (0) : K0=Kf1/Kf2=1010,7 / 108,7 =100. Le complexe [CaY]2- est plus stable que le complexe [MgY]2-. Avant ajout EDTA , après ajout NET : Ca2+ +HI2- + NH3 = [CaI]- + NH4+(3) K = [[CaI]- ][ NH4+] / ([Ca2+][HI2-][NH3]) [CaI]- + H+ = Ca 2+ + HI2- avec Kd1 = ([Ca2+][HI2-] / ( [[CaI]- ] [H+]) soit [[CaI]- ]/ ([Ca2+][HI2-]) = 1/(Kd1[H+]) NH4+= NH3+ H+ avec Ka = [NH3] [H+]/ [ NH4+] soit [ NH4+] / [NH3] = [H+] / Ka par suite K = 1/(KaKd1) = 109,2 *105,4=1014,6. de même : Mg2+ +HI2- + NH3 = [MgI]- + NH4+(4) K = [[MgI]- ][ NH4+] / ([Mg2+][HI2-][NH3]) [MgI]- + H+ = Mg2+ + HI2-avec Kd2 = ([Mg2+][HI2-] / ( [[MgI]- ] [H+]) soit [[MgI]- ]/ ([Mg2+][HI2-]) = 1/(Kd2[H+]) NH4+= NH3+ H+ avec Ka = [NH3] [H+]/ [ NH4+] soit [ NH4+] / [NH3] = [H+] / Ka par suite K = 1/(KaKd2) = 109,2 *107=1016,2.(4) prépondérant par rapport à (3) Le complexe le plus stable [MgI]- se forme et donne la teinte rouge violacée à la solution. EDTA ajouté en défaut : Ca2+ +H2Y2- + 2NH3 = [CaY]2- + 2NH4+. (5) K1=[[CaY]2- ][ NH4+]2 / ([Ca2+][H2Y2-][NH3]2 ) [CaY]2- + 2H+ = Ca2++H2Y2-] avec Kd3 = [Ca2+][H2Y2-] / ([[CaY]2- ][H+]2) K1= 1/(Kd3Ka2) = 1010,7 * 1018,4 = 1029,1. ( 5 ) est prépondérant par rapport à (4 ) [CaY]2- étant incolore, la solution reste rouge violacée. Juste avant l'équivalence : Ca2+ devient minoritaire [MgI]- + H2Y2- + NH3 = [MgY]2- + NH4+ + HI2- (5) - (4) -(0) K=1029,1 / (1016,2 *102)= 1010,9. HI2- : teinte bleue A l'équivalence on observe un changement de teinte : passage du rouge violacé au bleu. L'ion magnésium s'est substitué à l'ion calcium pour provoquer le changement de teinte. A l'équivalence d'un dosage les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Si Véq = 10,4 mL calcul de [Mg2+] d'après (5) : n(Ca2+) = n(H2Y2-) ; [Ca2+]*20 =0,0504*10,4 ; [Mg2+] =0,0262 mol/L.
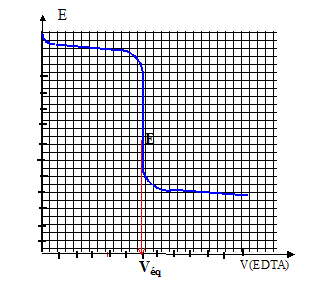
Potentiométrie : Dans un bécher on introduit :V3= 20,00 mL d'une solution S de nitrate de calcium, 25 mL d'un tampon ammoniacal de pH=9,5, une goutte de complexe [HgY]2- à 0,025 mol/L, environ 100 mL d'eau permutée. Constante de formation du complexe [HgY]2- : Kd3 =10-21. Installer une électrode au calomel et une électrode à cupule de mercure. Placer la solution de sel dissodique de l'éthylènediamminetétracétique ( noté EDTA) de concentration CEDTA=0,0504 mol/L dans une burette au 1/20 de mL. Equation du dosage : Ca2+ +H2Y2- + 2NH3 = [CaY]2- + 2NH4+. (5) Potentiel E de l'électrode indicatrice : couple redox Hg2+/Hg : E° =0,86 V Hg2++2e- =Hg E = E°(Hg2+/Hg) + 0,06/2 log [Hg2+] or : Hg2+ +H2Y2- + 2NH3 = [HgY]2- + 2NH4+. (6) K=[[HgY]2- ][ NH4+]2 / ([Hg2+][H2Y2-][NH3]2 ) [HgY]2- + 2H+ = Hg2++H2Y2-] avec Kd3 = [Hg2+][H2Y2-] / ([[HgY]2- ][H+]2) K= 1/(Kd3Ka2) = 1021 * 1018,4 = 1039.4. ( 6 ) est prépondérant par rapport à (5 ) je conclus : le volume de la solution variant peu ( on a ajouté 100 mL d'eau), et le complexe [HgY]2- étant plus stable que [CaY]2-, [HgY]2- = constante.
Potentiel E de l'électrode indicatrice en fonction de [Y4-] : [HgY]2-=Hg2+ +Y4- ; (7) Kd4 = [Y4-][Hg2+] / [[HgY]2- ] soit [Hg2+] = Kd4[[HgY]2- ]/[Y4-] E = E°(Hg2+/Hg) + 0,03 log (Kd4[[HgY]2- ]/[Y4-]) avec Kd4[[HgY]2- ] = constante notée A E = E°(Hg2+/Hg) + 0,03 log A -0,03log [Y4-] et en posant B=E°(Hg2+/Hg) + 0,03 log A = constante E=B-0,03log [Y4-]
[CaY]2-=Ca2+ +Y4- ; (7) Kd5 = [Y4-][Ca2+] / [[CaY]2- ] soit [Y4-] = Kd5[[CaY]2- ]/[Ca2+] repport dans E=B-0,03log [Y4-] E=B-0,03log(Kd5[[CaY]2- ]/[Ca2+]) et en posant D=B-0,03logKd5 = constante E= D+0,03 log([Ca2+]/[[CaY]2- ]) [Ca2+] diminue au cours du dosage tandis que [[CaY]2- ] augmente ; log([Ca2+]/[[CaY]2- ]) diminue ainsi que le potentiel E. A l'équivalence :[Y4-] croît rapidement en effet [Ca2+] proche de zéro et [Y4-] = Kd5[[CaY]2- ]/[Ca2+] or E=B-0,03log [Y4-] : d'où une forte diminution de E. Après l'équivalence, [Y4-] croît lentement du fait de l'ajout d'EDTA ; en conséquence E diminue.
|
||||||||
|
|
||||||||
|
|
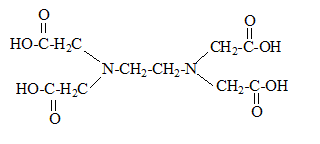 noté
H4Y
noté
H4Y