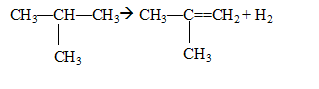|
enseignement, concours caplp interne 2005 : les essences En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
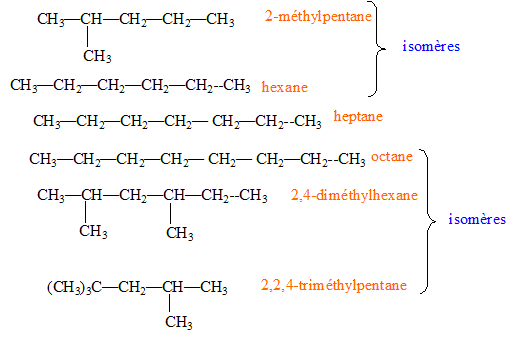
La formule brute nous renseigne sur la nature et le nombre d'éléments chimiques constituant la molécule. La formule semi-développée nous renseigne sur la chaîne ( ou squelette) carbonée et met en évidence les groupes fonctionnels de la molécule. Des isomères ont même formule brute mais des arrangements spatiaux différents.
Détermination de la formule d’un hydrocarbure : Pour déterminer la formule d’un hydrocarbure, on réalise la combustion de 160,0 grammes de ce produit dans le dioxygène. On obtient 494,0 grammes de dioxyde de carbone et 227,4 grammes d’eau. Equation équilibrée de la réaction de combustion complète dans le dioxygène : CxHy + (x + 0,25 y)O2 = x CO2 + ½yH2O Quantités de matière : n(CO2) = m/MCO2 = 494,0 / 44 = 11,227 mol n(H2O) = m/MH2O = 227,4 / 18 = 12,633 mol n(CxHy) = 160/M mol D'après les coefficients stoechiomètriques : n(CO2) = x n(CxHy) ; 11,227 = 160 x/M avec M = 12 x + y 11,227(12x+y) = 160x ; 25,276 x =11,227 y ; x = 0,4441 y ; y = 2,25 x. or x et y sont entiers et y doit être pair d'où : x =8 k ; y= 18k ; formule brute : [C8H18]k avec k entier. Ce composé est un hydrocarbure saturé ( CnH2n+2) possédant de nombreux isomères.
L’indice d’isooctane : Pour éviter le phénomène d’auto-inflammation, il préférable d’avoir des hydrocarbures à chaîne ramifiée pour lesquels les températures d'auto-inflammation sont supérieures à celles des hydrocarbures à chaîne linéaire. L’indice 100 est affecté à l’isooctane pur (100% d’isooctane) pour lesquel la température d'auto-inflammation est voisine de 456°C. L’indice 0 est affecté à l’heptane pur pour lesquel la température d'auto-inflammation est voisine de 221°C. Pour diminuer les « cognements » des moteurs et augmenter l’indice d’isooctane, on ajoute à l’essence un additif antidétonant, le plomb tétraéthyle Pb(C2H5)4 à raison de 0,4g/L d’essence. Inconvénient de l’utilisation de ce produit dans les carburants : rejet de plomb dans l'environnement lors de la combustion du carburant. Pour éviter cet inconvénient on utilise les pots catalytiques et des carburants dit" sans plomb".
"craquage catalytique " : ruptures des longues chaînes carbonées des produits dits "lourds". Ces derniers passent dans un four dont la température est comprise entre 400 et 600°C. Ce four ne contient pas d'oxygène. Les catalyseurs utilisés sont : chrome ; SiO2, Al2O3. " reformage " : obtention d'hydrocarbures à chaînes ramifiées à partir d' hydrocarbures à chaînes linéaires.( P = 20 à 50 bars , T = 500 °C , catalyseur AlCl3). Par alkylation, l’isooctane est obtenu à partir du 2-méthylpropane dont une partie est transformée en 2-méthylpropène, ces deux corps réagissant entre eux. Les différentes réactions conduisant à l'isooctane à partir du 2-méthylpropane sont : * déshydrogénation du 2-méthylpropane en présence d'acide sulfurique :
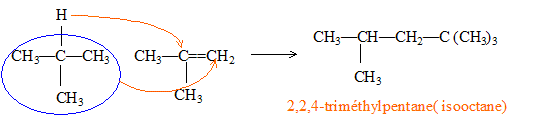
* puis addition du 2-méthylpropane au diméthylpropène :
|
|
|
|
|
|
|