|
De l'eugénol à la vanilline bac S Afrique 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
La vanille est l'épice la plus utilisée au monde. La vanilline est l'arôme principal des gousses de vanillier. Les gousses contiennent peu de vanilline : 1 kg de gousses de vanille donnent 25 g de vanilline. Compte-tenu du prix de revient élevé de la vanille, la vanilline naturelle est très souvent remplacée par la vanilline de synthèse (dont le prix de revient est environ 300 fois moins élevé). La synthèse de la vanilline se fait en trois étapes dont seulement deux seront présentées dans le problème.
Extraction de l'huile essentielle du clou de girofle.
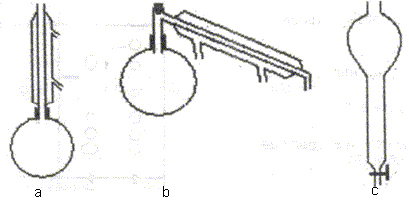
Pour extraire l'huile essentielle des clous de girofle, dont le principal constituant est l'eugénol, on introduit dans un ballon 100 mL d'eau distillée, 5 g de clous de girofle en poudre et quelques morceaux de pierre-ponce. On met en place le montage d'hydrodistillation, on porte à ébullition et on fait fonctionner jusqu'à recueillir 30 à 40 mL de distillat dans un erlenmeyer. Parmi les montages de verrerie ci-dessous, identifier celui à utiliser. b :
hydrodistillation.
L'ajout de chlorure de sodium diminue la solubilité de l'eugénol dans la phase aqueuse. Les deux autres solvants proposés dans les tableaux sont-ils utilisables pour réaliser l'extraction ? Justifier à l'aide des tableaux de données. Le solvant d'extraction ne doit pas être miscible avec la phase aqueuse : l'éthanol étant miscible à l'eau ne convient pas. de plus l'espèce à extraire doit être très soluble dans le solvant organique : le cyclohexane peut convenir
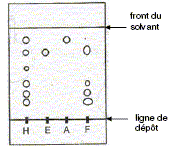
On réalise lune chromatographie sur couche mince de l'huile essentielle extraite des clous de girofle. On dépose sur la plaque, en solution dans le dichlorométhane
L'huile essentielle extraite des feuilles de giroflier contient-elle de l'éthanoate d'eugényle. ? Justifier. L'éthanoate d'eugényle est un corps pur servant de référence ; (F) après élution ne présente pas de tache ayant le même rapport frontal que l'étalon (A) : l'huile essentielle préparée à partir des feuilles ne contient pas d'éthanoate d'eugényle. Quelles sont les espèces chimiques pures identifiables contenues dans l'huile essentielle de clous de girofle ? (A) et (E) sont des corps purs servant d'étalons ; (H) après élution présente des taches ayant le même rapport frontal que les étalons (A) et (E) : l'huile essentielle préparée à partir des clous contient de l'éthanoate d'eugényle et de l'eugénol.
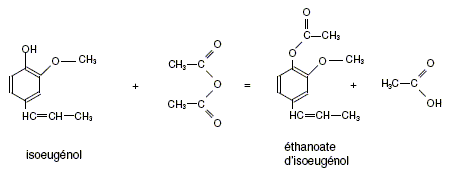
1ère étape : synthèse de l'éthanoate d'isoeugénol. Le mode opératoire est le suivant : - introduire dans un ballon 5,0 g d'isoeugénol, 10 mL d'anhydride éthanoïque et quelques grains de pierre ponce ; - réaliser le montage pour un chauffage à reflux ; amener le mélange au reflux et le maintenir pendant 40 min ; - refroidir dans un bain de glace 10 min ; - verser le contenu du ballon dans 30 mL d'eau glacée et laisser cristalliser l'éthanoate d'isoeugénol ; - filtrer le solide sur Büchner. La réaction est représentée par l'équation suivante :
Nocif en cas d'ingestion et irritant pour les
yeux, les voies respiratoires et la
peau. Soluble dans la plupart des solvants organiques
et insoluble dans l'eau glacée. Corrosif, inflammable, provoque des
brûlures.Réagit avec
l'eau. Quel est le rôle du chauffage à reflux ? En travaillant à température modérée, on accélère la réaction tout en évitant les pertes de matière : les vapeurs qui se dégagent, se condensent dans le refrigérant et retombent dans le milieu réactionnel. Pourquoi utilise-t-on un anhydride d'acide plutôt qu'un acide carboxylique pour effectuer cette réaction ? Avec l anhydride la réaction est totale ; avec l'acide carboxylique correspondant, la réaction est limitée par l'hydrolyse de l'ester. Pourquoi verse-t-on le contenu du ballon dans de l'eau glacée ? L'éthanoate d'isoeugénol est insoluble dans l'eau glacée. Calculer la quantité de matière initiale de chacun des réactifs. isoeugénol : n = m/M = 5,0/164 = 3,048 10-2 mol ~ 3,0 10-2 mol. anhydride : m (g)= volume (mL) * densité = 10*1,08 = 10,8 g n = m/M = 10,8 / 102 =0,106 ~ 0,11 mol. Calculer la masse maximale d'éthanoate d'isoeugénol que l'on pourrait obtenir par cette synthèse. L'isoeugénol constitue le réactif limitant : on peut espérer obtenir au mieux 3,048 10-2 mol d'éthanoate d'isoeugényle : m = n M = 3,048 10-2 *205=6,2 g. L'expérimentateur a obtenu 5,6 g de cristaux d'éthanoate d'isoeugénol. Le rendement de cette synthèse est défini comme étant le rapport de la masse de produit obtenu expérimentalement sur la masse de produit qui serait obtenu dans l'hypothèse d'une réaction totale. Calculer le rendement de cette synthèse. 5,6*100/6,2 = 90 %.
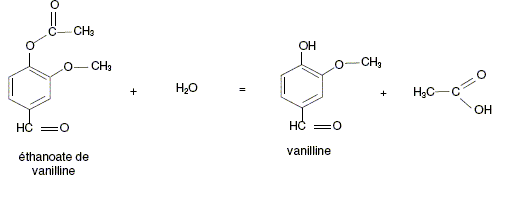
2ème étape et 3ème étape : synthèse de l'éthanoate de vanilline et obtention de la vanilline. Le mode opératoire relatif à la synthèse de l'éthanoate de vanilline à partir de l'éthanoate d'isoeugénol (2ème étape) ne sera pas explicité. La dernière étape consiste tout d'abord à dissoudre les cristaux d'éthanoate de vanilline dans un ballon contenant 10 mL d'éthanol et d'ajouter de l'acide chlorhydrique concentré. Après 30 minutes de chauffage à reflux, on refroidit le ballon dans un bain d'eau glacée puis on sépare les phases aqueuse et organique. La phase organique est séchée, le solvant est évaporé et on récupère un solide sentant la vanille. La réaction de synthèse de la vanilline est représentée par l'équation suivante. Il s'agit de l'hydrolyse d'un ester.
Donner deux caractéristiques de cette réaction. lente et limitée par l'estérification. L'acide chlorhydrique concentré est un catalyseur de la réaction de synthèse de la vanilline. Qu'appelle-t-on un catalyseur en chimie ? Un catalyseur accélère une réaction : il participe à la réaction mais se retrouve régénéré en fin de réction. Un catalyseur peut orienter une réaction quand deux issues sont possibles. Un catalyseur ne permet pas de réaliser une réaction thermodynamiquement impossible.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|