|
Les couleurs du bleu de bromothymol bac S France 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Titrage acido-basique avec le bleu de bromothymol. Un flacon d'hydroxyde de sodium ( Na+aq + HO-aq) a une concentration molaire inconnue. On note S cette solution. On prélève un volume Vs = 10,0 mL de la solution S que l'on verse dans un erlenmeyer. On titre cet échantillon par de l'acide chlorhydrique ( H3O+aq + Cl-aq) dont la concentration molaire est Ca = 1,00 10-1 mol/L, en présence de quelques gouttes de bleu de bromothymol comme indicateur de fin de titrage. Il faut verser un volume VE = 12,3 mL de solution titrante pour atteindre l'équivalence. Ecrire l'équation de la réaction support du dosage. H3O+aq + HO-aq = 2H2O(l). Identifier les couples acide / base mis en jeu. H3O+aq /H2O(l) et H2O(l) / HO-aq Définir l'équivalence d'un titrage. A l'équivalence les quantités de matière de réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence l'autre réactif est en excès. CB =0,123
mol/L
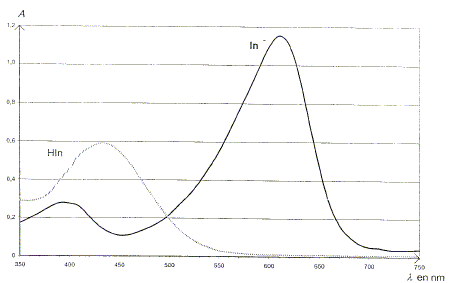
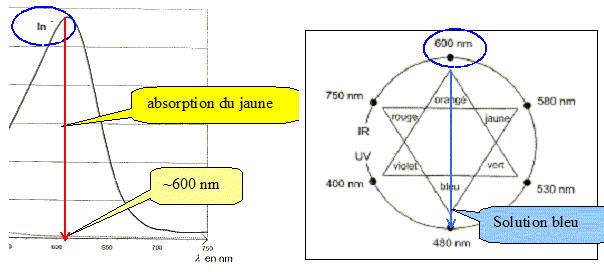
A quelle longueur d'onde l0 faut-il régler le spectrophotomètre afin que l'absorbance de la forme acide soit quasiment nulle et celle de la forme basique maximale ?
On appelle c la concentration molaire du bleu de bromothymol apporté dans ces solutions. Après réglage du zéro du spectrophotomètre, on peut admettre que l'absorbance de telles solutions s'exprime par : A = AHIn + AIn-. On mesure alors le pH de chacune de ces solutions et après avoir réglé un spectrophotomètre à la longueur d'onde l0, on mesure l'absorbance A de chacune de ces solutions en utilisant des cuves identiques.
Calculer la quantité de matière nBBT en bleu de bromothymol dans chaque solution.
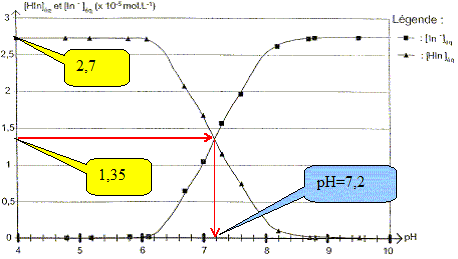
Montrer que la concentration molaire c du bleu de bromothymol apporté dans chaque solution vaut c = 2,7 10-5 mol/L.
Montrer qu'à la longueur d'onde l0 l'absorbance peut s'écrire : A= AIn-. L'absorbance AHIn de la forme acide étant nulle, A = AHIn + AIn-. s'écrit : A = AHIn. On peut montrer que l'absorbance A est donnée par : A= k[IN-]éq où k est une constante. Dans la solution S13 l'absorbance est maximale et a pour valeur Amax. On peut alors supposer que la concentration effective en HIn dans cette solution est négligeable devant celle de In-. Quelle est la relation entre Amax et c ? c =[HIn]éq + [In-]éq ; or [HIn]max ~ 0 d'où c = [In-]max ; de plus A= k[IN-]max d'où Amax = k c. Montrer que dans les solutions étudiées, la concentration effective en In- peut se calculer par : [IN-]éq =A c/Amax. A= k[IN-]éq et Amax = k c d'où k =Amax/ c. Par suite
A=Amax[IN-]éq
/ c
soit :
[IN-]éq
=A
c/Amax.
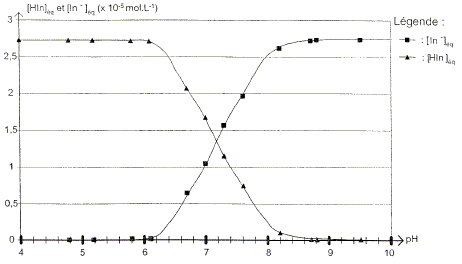
A partir des mesures précédentes, il est possible de calculer les concentrations effectives des formes acide [HIn]éq= c-[In-]éq et basique du bleu de bromothymol dans chacun des 13 échantillons et ansi construire le diagramme de distribution des espèces du couple HIn/ In-.
Pour quelle valeur du pH la concentration effective en HIn est-elle égale à celle de In- ?
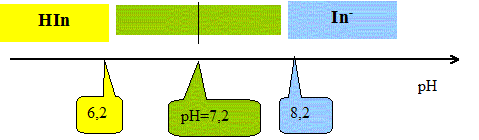
Trouver la relation entre le pH et le pKa et en déduire le pKa du bleu de bromothymol à 25°C. Ka = [H3O+aq][ In-aq] / [HIn aq] s'écrit : log Ka = log [H3O+aq] + log ([ In-aq] / [HIn aq]) -log Ka =- log [H3O+aq] - log ([ In-aq] / [HIn aq]) ; pKa = pH -log ([ In-aq] / [HIn aq]) pH = pKa + log ([ In-aq] / [HIn aq]). Or à pH=7,2, [ In-aq] / [HIn aq] =1donc : pKa = 7,2. On considère qu'une solution de bleu de bromothymol, éclairée en lumière blanche, prend sa teinte acide lorsque pH<pKa-1 et prend sa teinte basique lorsque pH> pKa+1 Donner le diagramme de prédominance des espèces et ajouter à ce diagramme les couleurs respectives de chaque forme. Quelle est la couleur de la solution dans la zonre de virage ?
Quelle est la couleur de la solution contenue dans l'erlenmeyer avant l'équivalence ? Comment repère t-on l'équivalence ? Avant l'équivalence l'ion HO- est en excés ( teinte bleu, milieu très basique) ; après l'équivalence l'ion oxonium est en excès ( teinte jaune, milieuu très acide). On repère l'équivalence par le changement de teinte de l'indicateur coloré. Lors de ce titrage le pH du mélange réactionnel à l'équivalence est égal à 7. Pourquoi peut-on affirmer que le bleu de bromothymol convient pour ce titrage ? La zone de virage de l'indicateur coloré [6,2 - 8,2 ] contient le pH du point équivalent.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||