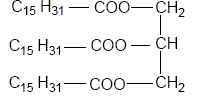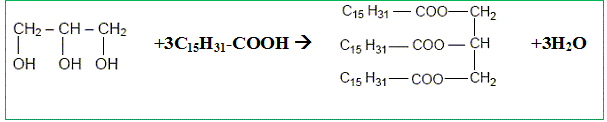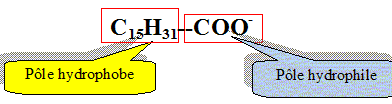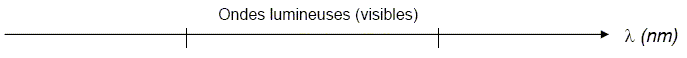|
Savon ; eau oxygénée ; ondes électromagnétiques bac SMS Réunion 2006. |
||||||||
|
||||||||
|
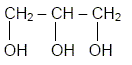
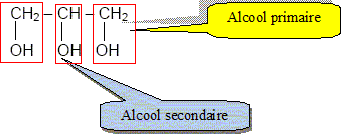
Le glycérol a pour formule semi
développée : Recopier la formule et entourer les groupes fonctionnels « alcool ».
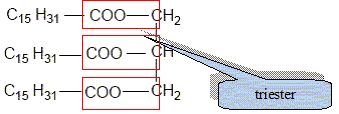
Recopier et compléter : le glycérol est donc un tri-alcool(famille chimique). Le glycérol est-il soluble dans l’eau ? Le glycérol, comme les alcools, est soluble dans l'eau. Les triglycérides forment l’essentiel des huiles et des graisses ; ce sont des triesters résultant de l’action du glycérol avec des acides gras. La palmitine est un triglycéride ; sa formule est :
Recopier la formule et entourer les groupes fonctionnels ester.
L'eau oxygénée. Il se vend en pharmacie de l’eau oxygénée qui titre 10 volumes : cela veut dire que sa concentration en volumes vaut « 10 volumes » Un tel flacon d’eau oxygénée a été entreposé en pleine lumière et à une température supérieure à 20°C. On souhaite vérifier si l’indication portée sur ce flacon est toujours valable. Pour vérifier le titre de cette eau oxygénée, on réalise un dosage de l’eau oxygénée par une solution de permanganate de potassium. Les demi-équations électroniques de la réaction sont : MnO4- + 8 H+ + 5e- = Mn2+ + 4H2O.(1) H2O2 = O2 + 2 H+ + 2e-.(2) Écrire l’équation bilan de la réaction. On rappelle qu’il ne doit plus figurer d’électrons e- dans l’équation de la réaction de dosage.. Multiplier (1) par deux : 2MnO4- + 16 H+ + 10e- = 2Mn2+ + 8H2O. Multiplier (2) par cinq : 5H2O2 = 5O2 + 10 H+ + 10e-. puis ajouter : 2MnO4- + 16 H+ + 10e- + 5H2O2 = 2Mn2+ + 8H2O + 5O2 + 10 H+ + 10e-. Puis simplifier : 2MnO4- + 6 H+ + 5H2O2 = 2Mn2+ + 8H2O + 5O2. Préciser la
nature de ce gaz.
O2,
dioxygène. A l’équivalence du dosage, une
coloration rose apparaît. Définir
l’équivalence d’un
dosage. Pourquoi
apparaît-il une couleur rose à
l’équivalence ? Avant l'équivalence, l'ion permanganate, de couleur violette, seul ion coloré, est en défaut : le milieu réactionnel est incolore. Après l'équivalence, cet ion permanganate est en excès : d'où la couleur rose violette observée. On trouve que la concentration molaire en peroxyde d’hydrogène de l’eau oxygénée vaut : C = 0,625 mol.L-1. Sachant que le titre T (ou concentration en volume) de l’eau oxygénée se calcule à partir de la concentration molaire C de l’eau oxygénée à l’aide de la relation : T = 11,2 . C. montrer que ce flacon d’eau oxygénée entreposée dans de mauvaises conditions ne titre plus que 7 volumes. T= 11,2*0,625 = 7 volumes. Ecrire l’équation-bilan de la dismutation de l’eau oxygénée qui s’est produite dans la bouteille sachant que l’on obtient de l’eau et du dioxygène. 2H2O2 --> O2 + 2H2O.
Ondes électromagnétiques. On considère l’axe gradué des ondes électromagnétiques ci-dessous, à recopier sur la copie.
A quelle grandeur physique est associée le symbole l. longueur d'onde . Indiquer sur l’axe les valeurs limites (dans le vide) du spectre visible. Préciser sur l’axe les couleurs correspondant à ces deux limites. Situer, sur l’axe recopié, le domaine des rayons ultraviolets U.V. et celui des infrarouges I.R.
Choisir, parmi les valeurs suivantes celle(s) de la célérité c de la lumière dans le vide : 300 000 km.h-1 ; 3 x 108 m.s-1 ; 300 000 km.s-1 ; 3 x 1018 m.s-1. Ces valeurs sont-elles toutes différentes ? 3 108 m/s = 300 000 km.s-1. Les autres valeurs proposées sont fausses.
Une onde électromagnétiques peut s’interpréter comme un flux de photons : chaque photon transporte une énergie E = hn= hc/l. h = 6,63 x 10-34 J.s (constante de Planck). Quelle grandeur physique désigne le symbole n ? Quelle est son unité ? fréquence en hertz (Hz). Quelle est l’unité d’énergie E ? Joule (J). Calculer l’énergie d’un photon U.V. pour lequel l = 300 nm ( 1 nm = 10-9 m). E = hc/l=6,63 10-34 *3 108 / 300 10-9 =6,6 10-19 J. Le nombre de personnes concernées par le mélanome malin (forme de cancer de la peau) a doublé en France en dix ans. Quel est le type de rayonnement électromagnétique qui en est responsable ? UV. Citer 2 exemples de sources de ce rayonnement. Soleil, lampes à bronzer UV.
|
||||||||
|
|
||||||||
|
|