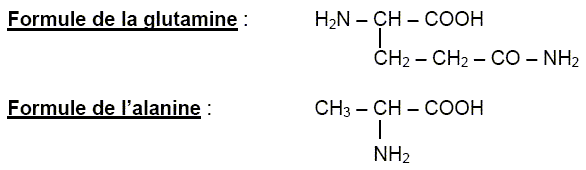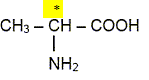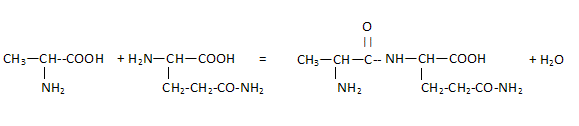|
synthèse peptidique ; eau de Javel ; radiothérapie métabolique bac SMS France septembre 2007. |
|||||||||
|
|||||||||
|
Un dipeptide est formé à partir de L-alanine et de L-glutamine.
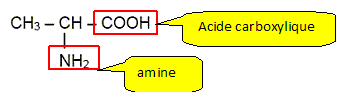
Sur la formule de l'alanine repérer les groupes caractéristiques amine et acide carboxylique.
Pourquoi dit-on que l'alanine est un acide a-aminé ? Le groupe amine NH2 et le groupe acide carboxylique COOH sont portés par le même atome de carbone.
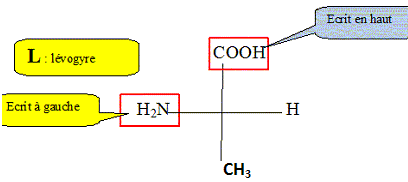
Un atome de carbone asymétrique : - est un atome de carbone tétragonal ( 4
directions de liaison) - les 4 substituants ( groupes liés
à ce carbone) sont différents.
L'eau de Javel. Sur l'étiquette d'un flacon commercial on lit : eau de Javel ; 48 °chl ; 250 mL. Définir le degré chlorométrique d'une eau de Javel. On appelle degré ou titre chlorométrique d'une eau de Javel le volume de dichlore, mesuré en litres dans les conditions normales de température et de pression, nécessaire à la fabrication d'un litre de cette eau de Javel. En déduire que le volume de dichlore que peut libérer, dans les conditions normales de température et de pression, les 250 mL d'eau de javel contenus dans le flacon commercial est V=12 L. 1 L de cette eau de Javel est susceptible de libérer 48 L de dichlore. 250 mL = 0,25 L d'où V = 0,25*48 = 12 L. On prélève à partir de la solution commerciale précédente un volume V= 10 mL d'eau de javel que l'on dilue avec de l'eau distillée jusqu'à obtention d'un litre de solution diluée ( dilution au centième). Matériel disponible : pipette
jaugée de 10 mL, pipette jaugée de 20
mL, propipette ou pipeteur, fioles jaugées
de 500 mL et 1 L, bouchons, béchers. Le volume de la solution mère
prélévée est égale au
volume de la solution fille diluée,
divisé par 100 ( dilution au
centième) Prélever 10 mL de solution mère
à l'aide d'une pipette jaugée de 10
mL ( + pipeteur) Introduire dans une fiole jaugée de 1L et
compléter jusqu'au trait de jauge avec de
l'eau distillée. Boucher et agiter pour rendre
homogène. . t est 100 fois plus petit que le degré de la solution mère : t = 48/100 = 0,48°chl. L'eau de Javel réagit avec une solution de sulfate de fer (II), ion Fe2+ selon une réaction d'oxydoréduction dont l'équation bilan est : 2Fe2+ +ClO- + H2O= 2Fe3+ +Cl- + 2HO-. Ecrire les deux couples oxydant réducteur mis en jeu dans cette transformation. ClO- / Cl- et Fe3+/Fe2+. La demi équation électronique qui met en jeu les ions fer (II) s'écrit : Fe2+ = Fe3+ + e-. La demi équation électronique qui met en jeu les ions ClO- s'écrit : ClO- + H2O +2 e-= Cl- + 2HO-. A partir de ces deux équations, écrire l'équation de la réaction d'oxydoréduction. Multiplier tout par deux : 2Fe2+ = 2Fe3+ +2 e-. ClO- + H2O +2 e-= Cl- + 2HO-. puis ajouter : 2Fe2+ +ClO- + H2O= 2Fe3+ +Cl- + 2HO-.
Radiothérapie métabolique. La radiothérapie consiste à l'administration d'un radionucléide dont les rayonnements b- détruisent les cellules qui ont accumulé sélectivement ce produit. Parmi les radionucléides émetteurs b-, on utilise : l'iode 13153I, efficace dans certaines maladies de la thyroïde le phosphore 3215P, qui permet de diminuer l'excès de globules rouges le strontium 8938Sr, efficace pour réduire les métastases osseuses du cancer de la prostate. Définir le terme nucléide. L'ensemble des noyaux ayant le même nombre de nucléons A et le même nombre de protons Z. Donner le nom et la signification de chacun des nombres A, Z situés devant le symbole d'un élément AZX. A : nombre de nucléons, protons et neutrons ; Z : nombre de protons, nombre de charge. Indiquer le nombre de protons et de neutrons contenus dans le noyau de phosphore 3215P. Z= 15 protons ; 32-15 = 17 neutrons. Quelle est la particule émise lors d'une désintégration b- ? électron. Rappeler les deux lois de conservation utilisées dans les équations de désintégration radioactive. Conservation de la charge ; conservation du nombre de nucléons. Ecrire l'équation de désintégration radioactive de 13153I. On choisira le noyau fils parmi la liste suivante : 51Sb, 54Xe, 52Te. On donne le symbole de l'électron 0-1e. 13153I --> AZX + 0-1e. Conservation de la charge : 53=Z-1 d'où Z= 54 ; on identifie X à Xe. Conservation du nombre de nucléons : 131=A+0 ; A=131. 13153I --> 13154Xe + 0-1e.
Radioprotection. L"application de doses concentrées sur une partie de l'organe, destinées à détruire les cellules cancereuses, peut aller jusqu'à 100 mSv. Quel est pour le public la limite de l'équivalent de dose annuel ? 5 mSv. Citer deux effets sur l'organisme d'un surdosage en rayonnement radioactif. Les particules ionisantes et le rayonnement g sont capables de provoquer des réactions chimiques et des modifications dans la structure des molécules constituant la matière vivante. En particulier, ils peuvent induire des mutations génétiques lorsque l'ADN se trouve modifié. Malaises, vomissements, nausées, diarrhée, anorexie, grande fatigue ; modification de la formule sanguine
|
|||||||||
|
|
|||||||||
|
|