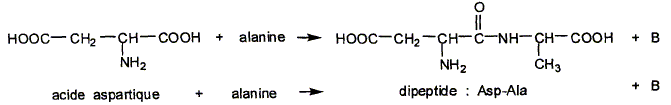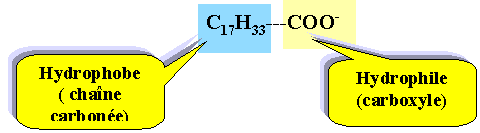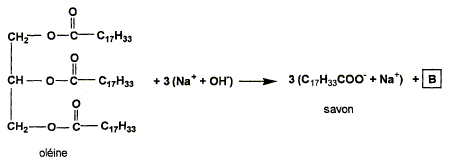|
Aspartame, les savons , bac SMS France 2008.
|
||||||||||||||||
|
||||||||||||||||
|
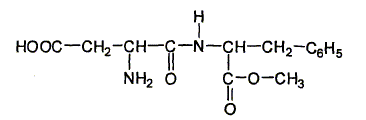
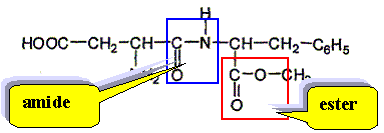
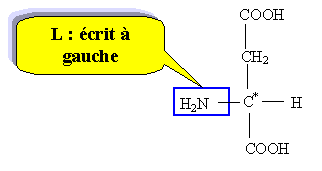
Chloé décide d'aller faire un pique nique à la campagne. Elle s'installe dans l'herbe et sort de son sac : des andwiches, une salade en vinaigrette, des fruits, une bouteille de 250 mL de boisson pétillante allégée en sucre, contenant de l'aspartame. La molécule d'aspartame est la suivante :
Recopier la formule et repérer clairement les groupes ester et amide.
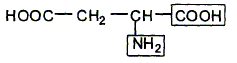
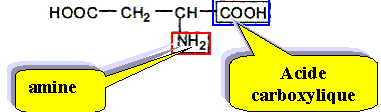
L'acide aspartique est un acide aminé essentiel. Dans certaines conditions, il peut réagir avec l'alanine pour former le dipeptide Asp-Ala que l'on retrouve dans l'hémoglobine :
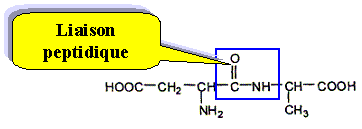
Entourer la liaison peptidique.
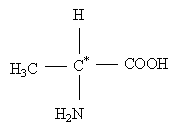
Ecrire la formule semi-développée de l'alanine.
Nommer B. H2O, eau En utilisant les abréviations Asp pour l'acide aspartique et Ala pour l'alanine, nommer les autres dipeptides susceptibles d'être obtenus. Ala-Ala ; Asp-Asp, Ala-Asp.
Les savons. Chloé mange sa salade dans une assiette en carton. Une rafale de vent renverse l'assiette pleine d'huile et de vinaigre sur son T-shirt. Elle décide de le nettoyer tout de duite. Pour cela elle dissout m(savon) = 10 g de copeaux de savon dans une bassine de façon à obtenir un volume V= 5,0 L d'eau savonneuse. Le savon est l'oléate de sodium. Sa formule est C17H33COO- + Na+, sa masse molaire est M(savon) = 304 g/mol. Montrer que chloé utilise n(savon) = 3,3 10-2 mol de savon.
Calculer la concentration molaire en savon C(savon) de la solution contenue dans la bassine.
Les propriétés détergentes sont dues à l'anion oléate C17H33COO- Entourer et nommer la partie hydrophile et la partie hydrophobe.
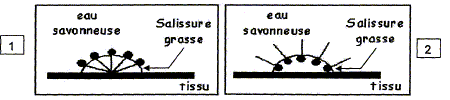
On schématise l'ion carboxylate ainsi : Considérons une sallissure grasse à la surface d'un tissu plongé dans une solution d'eau savonneuse. Indiquer le numéro du schéma correct et justifier.
1 : la partie lipophile ( hydrophobe) se fixe sur la graisse ; la partie hydrophile reste dans l'eau. Chloé se souvient que le savon provient de la réaction entre un corps gras et l'hydroxyde de sodium. Elle se pose alors la question suivante : quelle masse de corps gras ( ici l'oléine) faut-il pour fabriquer 10 g de savon que j'ai utilisé ? La réaction de formation du savon est la suivante :
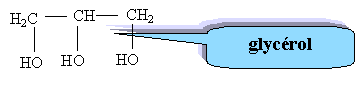
L'oléine est-elle un corps gras saturé ? Justifier. C17 H33 : on remarque que 33 = 2*17 -1 donc corps gras insaturé. ( dans le cas d'une structure saturée on aurait C17 H35 ) Donner le nom et la formule semi-développée de B.
Quelle est le nom de la réaction ? est-elle totale ? Saponification, réaction totale. Montrer que la quantité de matière d'oléine nécessaire est n(oléine) = 1,1 10-2 mol. D'après les nombres stoechiométriques de l'équation : n(savon) = 3 n(oléine) avec n(savon) = 3,3 10-2 mol. n(oléine) =3,3 10-2/3 = 1,1 10-2 mol. En déduire la masse d'oléine nécessaire M(oléine) = 884 g/mol).
|
||||||||||||||||
|
|
||||||||||||||||
|
|