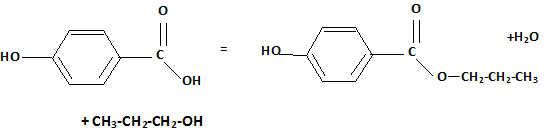|
Chimie organique : quelques propriétés de l'acide lactique BTS bioanalyses et contrôles 2008. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||
| .
. |
|||||
|
|||||
|
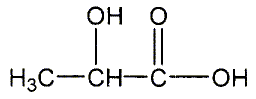
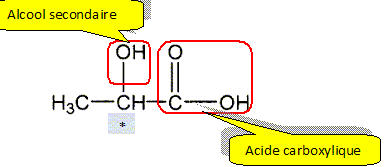
Il possède un atome de carbone asymétrique et donc peut exister sous la forme de deux énantiomères. Donner le nom de l'acide lactique en nomenclature systématique. acide 2-hydroxypropanoïque. Reproduire la formule semi-développée de l'acide lactique et entourer les fonctions organiques et les nommer. Mettre en évidence le carbone asymétrique.
Atome de carbone tétragonal lié
à quatre atomes ou groupes d'atomes
différents . Définir
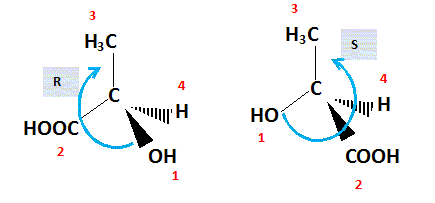
énantiomères. Une molécule chirale n'est pas
superposable à son image dans un miroir ( ou
dans une symétrie par rapport à un
plan). Cette molécule et son image dans un
miroir constituent un couple
d'énantiomères. Numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. OH (1) ; COOH (2) ; CH3 (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S).
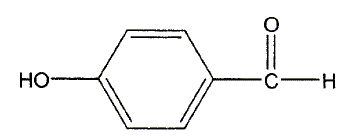
L'acide lactique constitue une matière première pour la synthèse du para-hydroxybenzoate de propyle. Ce dernier est utilisé comme conservateur dans l'industrie cosmétique. La synthèse du para-hydroxybenzoate de propyle s'articule en trois étapes que l'on se propose d'étudier. Etape 1 : préparation du propan-1-ol. L'acide lactique est déshydraté puis hydrogéné ; on obtient l'acide propanoïque CH3-CH2-COOH. L'acide lactique est ensuite transformé en propan-1-ol. A quelle classe d'alcool appartient le propan-1-ol ? alcool primaire. Quel type de réaction est mis en jeu lors de la transformation de l'acide propanoïque en propan-1-ol ? réduction. Etape 2 : préparation de l'acide para-hydroxybenzoïque. La fonction aldehyde du para hydroxybenzaldehyde ( représenté ci-dessous) est oxydée par le dichromate de potassium en milieu acide ( couple Cr2O72- / Cr3+ ). On obtient l'acide para-hydroxybenzoïque.
Ecrire les deux demi-équations d'oxydoréduction. Couple ( RCOOH / RCHO ) : 3 fois { RCHO + H2O = RCOOH +2H+ +2e- }( oxydation ) Couple Cr2O72- / Cr3+ : Cr2O72- + 14 H+ +6 e- = 2Cr3+ +7H2O ( réduction ) aditionner : Cr2O72- + 14 H+ +6 e- +3 RCHO +3H2O = 2Cr3+ +7H2O + 3RCOOH +6H+ +6e- simplifier : Cr2O72- + 14 H+ +3 RCHO +3H2O = 2Cr3+ +7H2O + 3RCOOH +6H+. Cr2O72- + 14 H+ +3 RCHO = 2Cr3+ +4H2O + 3RCOOH +6H+. Cr2O72- + 8 H+ +3 RCHO = 2Cr3+ +4H2O + 3RCOOH. Etape 3 : réaction entre le propan-1-ol et l'acide para-hydroxybenzoïque. Ecrire l'équation de la réaction.
Nommer cette réaction. estérification. Le rendement de la transformation est faible. Proposer une explication. La réaction est limitée par l'hydrolyse de l'ester. Proposer une méthode permettant d'améliorer le rendement. Eliminer l'eau au fur et à mesure qu'elle se forme. Remplacer l'acide par le chlorure d'acyle correspondant.
|
|||||
|
|
|||||
|
|