|
vitesse maximale en côte, pile à combustible. BTS Mava 2008. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
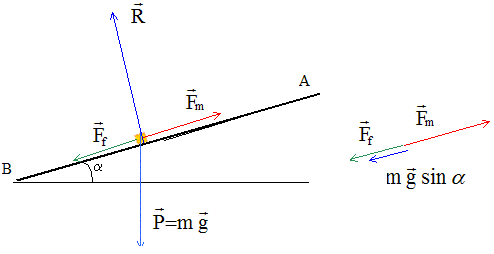
le constructeur d'un véhicule fournit les données suivantes : masse m= 1 t ; puissance utile du moteur Pm= 75 kW ; vitesse maximale sur route horizontale : Vm=150 km/h. On se propose de déduire de ces données la vitesse maximale que le véhicule peut atteindre en gravissant une côte de pente 10 %. Calculer la force motrice Fm, développée par le moteur lorsque le véhicule roule à vitesse constante sur route horizontale. Puissance (W) = force (N) * vitesse (m/s) Fm= Pm/Vm avec Vm = 150/3,6 = 41,67 m/s. Fm = 75 000 / 41,67 = 1800 N = 1,8 kN. On admet que l'ensemble des forces de frottements se résume à une force unique Ff opposée au mouvement et proportionnelle au carré de la vitesse : Ff= B v2 Montrer que la mesure de la vitesse maximale sur route horizontale permet de calculer la valeur de la constante B. La force motrice compense les frottements : Fm=Ff = B v2. B = Fm/ v2 = 1800 / 41,672 =1,037 ~1,04 kg m-1. Faire un schéma du véhicule en côte sur lequel apparaîtront les forces extérieures ramenées à son centre d'inertie, ainsi que leur projections sur l'axe de la route.
Pile à combustible. Certaines automobiles proposent un système de motorisation pile à combustible - moteur électrique. Le rôle de la pile consiste à convertir l'énergie chimique d'un carburant en énergie électrique : sa combinaison avec l'oxygène de l'air produit de l'électricité, et non de la chaleur. Le carburant est ici le dihydrogène, consommé suivant la réaction globale d'équation : 2H2 + O2 = 2H2O (1) Chaque moel de dihydrogène fait circuler dans le circuit électrique deux moles d'électrons, sous une tension E= 0,7 V. Calculer, en moles, la quantité de matière contenue dans 1 kg de dihydrogène, la masse de dioxygène nécessaire à sa combustion, la masse d'eau produite. Masse molaire du dihydrogène M= 2 g/mol. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) n(H2) = 1000/2 = 500 mol. n(O2 ) =½n(H2) =250 mol ; M(O2) = 32 g/mol. m(O2 ) = n(O2 ) M(O2) =250*32 = 8000 g = 8 kg. n(H2O) =n(H2) =500 mol ; M(H2O) = 18 g/mol. m(H2O
) = n(H2O ) M(H2O) =500*18 = 9000 g =
9
kg.
Montrer que la pile permet de faire circuler une charge Q= 2,7 104 Ah par kg de dihydrogène consommé suivant (1). NA = 6,02 1023 mol-1. Charge d'une mole d'électrons : |qe|NA =1,6 10-19 *6,02 1023 =96320 C 96320 C = 96320/3600 Ah = 26,76 Ah. Quantité de matière d'électrons = 2 n(H2) = 1000 moles. d'où : Q =26,76 *1000 ~ 2,7 104 Ah. On détermine expérimentalement le pouvoir calorifique du dihydrogène WQ= 142 MJ kg-1. L'énergie électrique fournie par la pile s'exprime par WE= QE ( E en V et Q en coulomb) Calculer l'énergie électrique produite par kg de H2. Q = 26,76 *1000 * 3600 = 9,63 107 C ; E = 0,7 ; WE=9,63 107 *0,7 = 6,74 107 J =67,4 MJ kg-1. 96,3 < 142 : toute l'énergie disponible n'est pas convertie en énergie électrique Si on admet que la pile a un rendement hP =50 % et, pour celui du moteur électrique, de 90 %, quel sera le rendement global de ce système de motorisation ? 0,5*0,9 = 0,45 soit 45 %. Quel autre intérêt ce système présente t-il en terme de rejet ? Pas de rejet de CO2 et d'oxyde d'azote : ce type de motorisation ne contribue pas à l'effet de serre.
production de dihydrogène. L'hydrogène présentant un problème de stockage, il est fabriqué à bord du véhicule à partir du méthanol, chauffé à 300 °C en présence de vapeur d'eau dans un dispositif appelé réformateur. Cette opération consomme de l'énergie : elle peut se modéliser par la transformation d'équation (2). CH3OH + H2O = 3H2+ CO2 (2). Calculer la masse de méthanol nécessaire pour produire 1 kg de dihydrogène, ainsi que la masse de CO2 produit. n(CH3OH) = n(H2) / 3 = 500 / 3 mol ; M(CH3OH) = 12+4+16 =32 g/mol. m(CH3OH) = n(CH3OH) M(CH3OH) = 500*32/3 = 5,3 kg. n(CO2) = n(H2) / 3 = 500 / 3 mol ; M(CO2) = 12+2*16 =44 g/mol. m(CO2) = n(CO2) M(CO2) = 500*44/3 = 7,3 kg. Montrer que l'ensemble des deux réactions, dans la pile et dans le réformateur, revient à brûler du méthanol suivant la réaction de combustion complète (3) à équilibrer : 1,5 fois { 2H2 + O2 = 2H2O } CH3OH + H2O = 3H2+ CO2 CH3OH +1,5 O2 = CO2 + 2H2O. Ce système présente t-il un avantage, en terme de rejet de gaz à effet de serre, sur une motorisation classique ? Pas d'avantage en terme de rejet de CO2 : il faudrait produire H2 d'une autre manière.
|
|||||||
|
|
|||||||
|
|