|
Le limonène : addition sur les alcènes capes agricole 2004 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
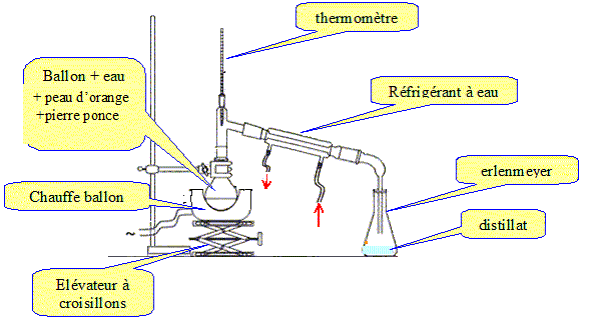
Extraction : On découpe en petits morceaux les peaux de deux oranges que l’on place dans un ballon à cols rodés de 250 mL. On réalise alors un montage d’entraînement à la vapeur d’eau. Dans un premier temps, les vapeurs et le distillat recondensé sont troubles voire opaques puis dans un deuxième temps les vapeurs obtenues deviennent claires, voire transparentes : ceci marque la fin de l’extraction. Le limonène est ensuite extrait avec du cyclohexane (le cyclohexane et le limonène forment un mélange liquide homogène). Le cyclohexane est ensuite éliminé au moyen d’un évaporateur rotatif. Dessiner le montage utilisé pour l’entraînement à vapeur.
Interpréter ce qui se passe dans chacun des deux temps de l’entraînement à la vapeur. Avant décantation on observe une émulsion : mélange hétérogène des molécules insolubles dans l'eau et d'eau. Après décantation : on observe deux phases séparées limpides. A la fin de l'extraction, les vapeurs ne contiennent que des molécules d'eau. Expliquer le principe de cette extraction et en déduire son intérêt. La méthode est basée sur l'existence d'un azéotrope dont la température d'ébullition est inférieure aux points d’ébullition des deux composés purs séparés. Entraînement à la vapeur d'eau des molécules volatiles des peaux d'orange. La vapeur, chargée de limonène, se condense dans le réfrigérant à eau. Les molécules insolubles dans l'eau occupent la partie supérieure du distillat. La partie inférieure contient les composés hydrosolubles. Quelle pièce de verrerie doit être principalement utilisée pour l’extraction postérieure à l’entraînement à la vapeur et avant passage à l'évaporateur rotatif ? Décantation dans une ampoule à décanter. Quel est l’intérêt d’utiliser un évaporateur rotatif (par rapport à une distillation sous pression atmosphérique) ?
Distillation sous vide
partiel. On chauffe modérément la
solution puis on fait décroître
progressivement la pression jusqu'à ce que
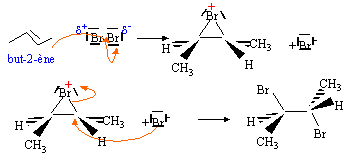
le solvant distille. Le limonène L fixe deux molécules de dibrome. Son hydrogénation complète sur nickel de Raney donne le 1-isopropyl-4-méthylcyclohexane ((CH3)2CH- est le groupe isopropyle). La monohydrogénation du limonène sur nickel de Sabatier donne le 4-isopropyl-l-méthylcyclohexène. On indique ici que le nickel de Sabatier obtenu par réduction de NiO est moins réactif que le nickel de Raney ; seules les doubles liaisons peu encombrées sont hydrogénées en présence de nickel de Sabatier. Réaction avec le dibrome. Quelle est la fonction mise en évidence par ce test caractéristique ? Double liaison éthylénique. Donner le mécanisme de cette réaction sur un exemple de molécule simple et préciser les caractéristiques stéréochimiques de cette réaction.
Combien d’insaturations comporte le limonène ? C10H16 : ½ [ 2*10 +2 -16] = 3 Quelle information concernant la structure du limonène obtient-on en considérant que deux équivalents de dibrome réagissent ? Que peut-on en conclure ? deux doubles liaisons éthyléniques + un cycle.
Quel est le réactif de la réaction et quelles sont les caractéristiques stéréochimiques de cette réaction ? Hydrogène ( gaz) et catalyse hétérogène : cis addition.
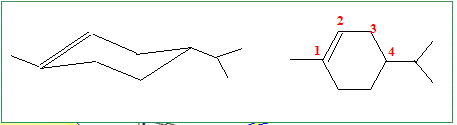
Quel rôle joue le nickel dans ces réactions d’hydrogénation ? Catalyseur. Donner la formule topologique du 4-isopropyl-l-méthylcyclohexène.
Si on ne tient pas compte de la différence de sélectivité entre nickel de Raney et nickel de Sabatier, quelles sont les formules possibles a priori pour le limonène ?
En tenant compte de cette différence de réactivité et sachant que le limonène n’est pas conjugué, donner sa formule topologique.
Combien la molécule de limonène possède-t-elle de stéréoisomères de configuration ? Justifier. Quelle est leur relation ? L'existence d'un atome de carbone asymétrique conduit à deux énantiomères. Représenter l’un d’eux en précisant sa stéréochimie.
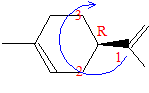
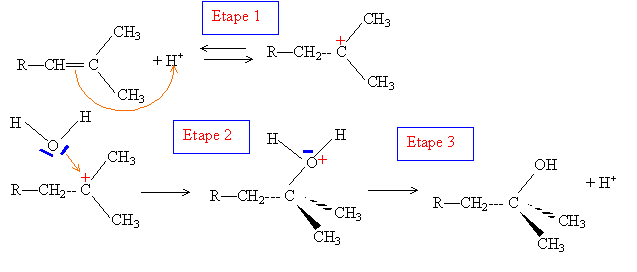
Quelques réactions du limonène : En présence d’acide sulfurique, le limonène fixe deux molécules d’eau. Justifier l’obtention d’un composé unique largement majoritaire. hydratation acido-basique à la double liaison carbone-carbone : passage à l'alcool
L'étape 1, formation du carbocation le plus stable, est cinétiquement la plus lente : elle est déterminante. La règle de Markovnikov permet de prévoir sur quel atome de carbone se fixe l'hydrogène de l'hydracide ( ou de H2O) : l'atome d'hydrogène se fixe sur l'atome de carbone le moins substitué ( formation du carbocation le plus stable )
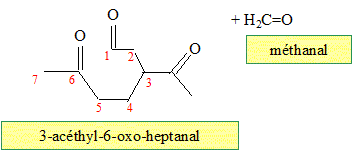
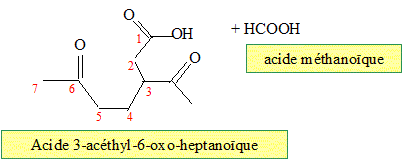
Quel(s) produit(s) fournit l'ozonolyse réductrice du limonène ? En présence d'un réducteur, l'aldehyde n'est pas oxydé en acide carboxylique.
Même question pour une ozonolyse non réductrice. Nommer dans chacun des cas les produits obtenus. En absence d'un réducteur, l'aldehyde est oxydé en acide carboxylique.
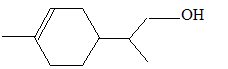
Dans certaines conditions, l’hydroboration du limonène suivie d’un traitement à l’eau oxygénée en milieu aqueux basique conduit à un unique composé de formule brute C10H18O. Dessiner le produit obtenu et proposer une explication de la sélectivité observée. addition anti-Markovnikov addition du diborane B2H6 ou hydroboration ; le bore, moins électronégatif que H, se fixe sur l'atome de carbone le moins encombré. puis l'hydrolyse de l'alkylborane conduit à l'alcool primaire.
|
|||||||
|
|
|||||||
|
|

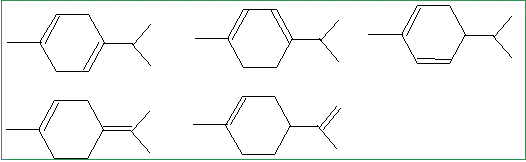
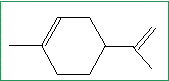
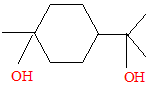 pas de carbone asymétrique.
pas de carbone asymétrique.