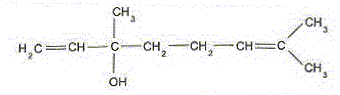|
Synthèse étahnoate de linalyle concours kiné APHP 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||
| .
. |
|||||||
|
|||||||
|
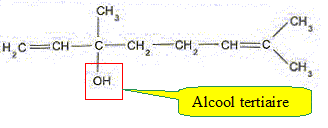
Entourer le groupe d'atomes caractéristique de la fonction oxygénée. Nommer et indiquer la classe de cette fonction oxygénée.
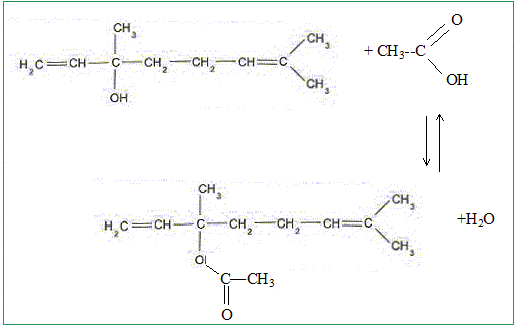
A quelle famille chimique l'éthanoate de linalyle appartient il ? Préciser le nom de l'acide carboxylique utilisé. Famille des esters. Acide utilisé : acidé éthanoïque ou acide acétique. Ecrire l'équation de la transformation chimique correspondant à cette synthèse en utilisant les formules semi-développées.
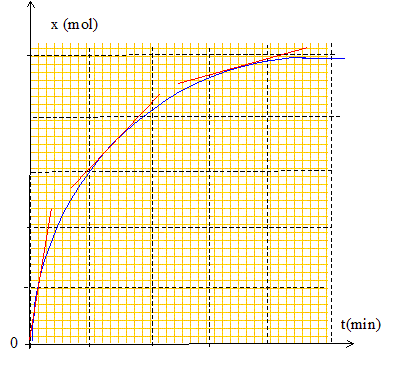
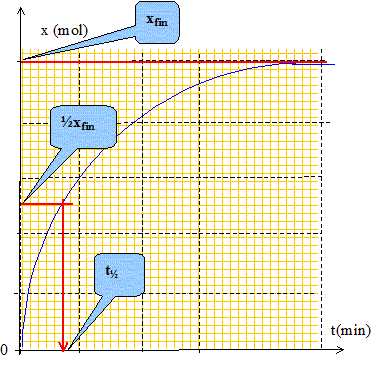
Définir le temps de demi-réaction noté t½. Comment le déterminer graphiquement ? Le temps de demi- réaction est la durée au bout de laquelle l'avancement molaire est égal à la moitié de l'avancement final xfin.
Pour réaliser la synthèse on prépare un mélange équimolaire des deux réactifs auquel on ajoute de l'acide paratoluène sulfonique. Ce dernier catalyse la synthèse étudiée. A quoi sert un catalyseur ? Un catalyseur augmente la vitesse de la réaction : l'équilibre est atteint plus rapidement ; la composition du mélange à l'équilibre n'est pas modifié. Une fois la transformation terminée et après refroidissement, on sépare l'éthanoate de linalyle par distillation. A partir de V=40 mL de linalol, on récupère V' = 2,5 mL d'acétate de linalyle. Définir puis calculer le rendement. Le résultat obtenu est-il en accord avec l'alcool utilisé ? Données : densité du linalol d = 0,87 ; densité de l'éthanoate de linalyle d'= 0,89. Masse molaire du linalol M(linalol) = 154 g/mol ; M( éthanoate de linalyle)=196 g/mol Aide aux calculs : 196*0,011 ~ 0,89*2,5 ; 0,87*40 ~154*0,22. Rendement = 100 * masse réelle d'ester / masse théorique dans le cas d'une réaction totale. Masse réelle d'ester : V'd' = 2,5*0,89 Quantité de matière linalol = quantité de matière théorique d'ester = Vd/M(linalol) = 40*0,87/154 Masse théorique d'ester : 40*0,87/154 *196 rendement : 100*2,5*0,89*154/( 40*0,87*196) ~ 100*2,5*0,89*154/ (154*0,22*196) = 196*1,1/(0,22*196) = 1,1/0,22 = 10*0,11/(2*0,11) = 5 %. Ce faible rendement est en accord avec le fait que le linalol est un alcool tertiaire. Pour améliorer le rendement, on peut faire réagir le lonalol avec un dérivé de l'acide utilisé. Donner la formule et le nom de ce dérivé.
|
|||||||
|
|
|||||||
|
|