|
Concours technicien police technique et scientifique 2008. Les 30 premières questions. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||
| .
. |
|||||||
|
|||||||
|
Des acides bases ; des ampholytes ; des énantiomères ; des phonèmes. Rappeler la définition d'une unité de masse atomique ( 1 u). masse d'un kg de proton ; masse d'un kg de neutron ; le 1/12è de la masse d'un noyau de carbone 12 ; le 1/12è de la masse de l'élément carbone. A quelle température sont définit les Ka ? O°C ; 20°C ; 25°C ; 273 K Comment nomme t-on les solutions qui sont composées de mélange d'acide faible et de base faible conjuguée en quantité équimolaire ? solutions équivalentes ; solution tampon ; solution neutre ; solution ampholyte. A quel type de montage électronique ( ou de composant électronique) se réfère le sigle CAN ? Convertisseur analogique numérique : fait correspondre à une tension binaire, numérique, une tension analogique, un nombre. Quelle est en écriture de Lewis la meilleur représentation de la molécule d'eau ?
Une solution aqueuse alcaline de chlorate et de
chlorure de sodium. Une solution aqueuse
alcaline d'hypochlorite et de chlorure de
sodium. Une solution aqueuse alcaline de chlorate de
sodium et de chlorure de potassium. Une solution aqueuse alcaline d'hypochlorite de
sodium et de chlorure de potassium.
Quelle est la configuration électronique du manganèse Z=25 ? 1 s2 2s3 2p4 3s2 3p4 3d6 4s4. 1 s2 2s2 2p6 3s2 3p4 3d5 4s4. 1 s2 2s2 2p6 3s2 3p6 3d5 4s2. 1 s2 2s2 2p6 3s2 3p4 3d6 4s3. Une solution est colorée si elle absorbe une partie des radiations de la lumière blanche. La couleur observée est la couleur complémentaire de la couleur absorbée. Une solution qui a une couleur magenta absorbe dans le: jaune, rouge, orange, vert.
Quelle est l'affirmation correcte concernant la pyridine C5H5N ? Le doublet libre de l'azote participe au système conjugué. Les substitutions nucléophiles se font prioritairement en position 1. La présence d'un électroattracteur dans le cycle favorise les réactions de substitution nucléophiles. (Le caractère électroattracteur exercé par l'azote appauvrit considérablement le noyau aromatique) La molécule présente un pKa voisin de celui d'une amine secondaire. Les amides de type RCONH2 sont transformés par LiAlH4 en : amine primaire ; amine secondaire ; amine tertiaire ; acide carboxylique. La réduction des aldehydes et de cétones par le borohydrure de sodium conduit à la formation : alcanes ; alcènes ; alcools ; esters. Le phénol est un composé : moins acide que les alcool donnant des substitutions électrophiles plus rapides que le benzène orientant les substitutions électrophiles en méta par rapport au groupe OH acyclique.
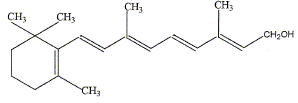
La réaction de phénylmagnésium avec une amine primaire conduit à la formation d'un : sel ; produit d'addition ; produit de substitution ; ammodium. Quelle est l'affirmation exacte ? Les isotopes ont le même nombre de protons et d'électrons, et un nombre différent de neutrons. Les isotopes ont même nombre de masse. Les isotopes naturels sont tous stables, les isotopes artificiels sont tous radioactifs. Les isotopes n'ont pas les mêmes propriétés chimiques. La molécule de vitamine A1 renferme :
Une fonction alcool secondaire, un centre d'asymétrie, une liaison double qui donne une configuration trans, une succession régulière de liaison double et simple. Les triglycérides : sont hydrolysables dans l'organisme humain ; sont des esters du glycérol ; sont des ethers oxydes du glycérol ; peuvent être synthétisés à partir du glycérol. Quel est le résultat de l'ozonolyse d'un alcène ?
Le sulfate de cuivre est hydraté à l'état solide. Placé dans une étuve, un échantillon de 36 g a une masse finale de 23 g. M(CuSO4) = 159,5 g/mol ; M(H2O) = 18 g/mol. La formule de sel cel hydraté est : CuSO4, 4H2O ; CuSO4, 5H2O ; CuSO4, 6H2O ; CuSO4, 7H2O. Quantité de matière de CuSO4 : n = m/M = 23 / 159,5 =0,144 mol. Masse molaire du sel hydraté CuSO4, x H2O ; 159,5 + 18 x par suite : 0,144 = 36/ (159,5 + 18 x) ; 159,5 + 18 x = 36/0,144=250 ; x = (250-159,5)/18 ; x=5. Concernant les modèles atomiques de l'atome d'hydrogène, quelle est la seule proposition exacte ? Le modèle de Rutherford implique que l'électron gravite autour du nouau en décrivant une orbite elliptique comme la terre autour du soleil. Il y a émission d'une radiation lorsque l'électron passe d'une orbite éloignée du noyau à une orbite plus proche. Les spectres d'émission de l'atome d'hydrogène sont continus. Dans son état fondamental, le rayon de l'orbite de Bohr est de 0,53 nm. ( c'est 5,2 10-11 m ou 0,53 pm) Quels sont les états d'hybridation des différents atomes de carbone dans la molécule d'arginine.
a et d : hybridation sp2 et b et c : hybridation sp3. a et d : hybridation sp3 et b et c : hybridation sp2. a et b : hybridation sp3 et d et c : hybridation sp2. d et b : hybridation sp3 et a et c : hybridation sp2.
Concernant la pression et la température d'un gaz quelle est l'unique proposition exacte. La pression s'exprime en pascals Pa avec 1 Pa = 1N/m. La pression P d'un gaz est la force qu'il exerce par unité de surface. Dans les relations physiques, on exprime la température d'un gaz en °C. 1 atm = 1 mbar.
423 mL ; 525 mL; 1286 mL ; 627 mL. L'air est assimilé à un gaz parfait : n = Pf Vf/(RTf) ; dans les poumons : n = Pc Vc/(RTc). Pf
Vf/(RTf) = Pc
Vc/(RTc) ; Vc= Vf
Pf / Pc Tc/
Tf = 525* 745/750 * (273+37) / (273-15) =
627
mL.525*745/750*310/258
6 mol/L ; 12 mol/L ; 14 mol/L ; 16 mol/L. Masse de 1 L : 1380 g ; masse d'acide pur : 1380* 0,64 = 883,2 g. Masse molaire HNO3 : M= 1+14+3*16 = 63 g/mol C= 883,2 / 63 =
14
mol/L.
|
|||||||
|
|
|||||||
|
|
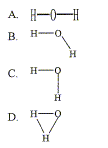 B,
molécule coudée, angle proche de 105
°.
B,
molécule coudée, angle proche de 105
°.
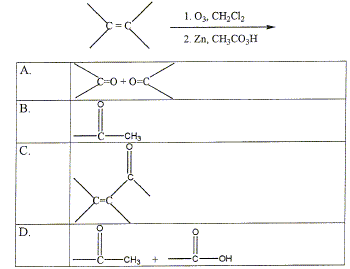 A.
A.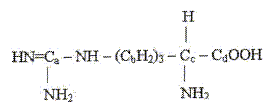
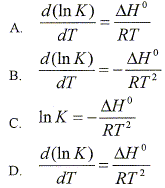 D.
D.