|
Etude cinétique d'une oxydation du magnésium concours technicien laboratoire 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
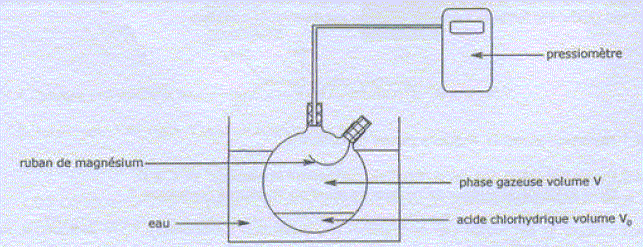
Mg(s) + 2H3O+(aq) = Mg2+(aq) + H2 (g) + 2H2O(l). La réaction est suivie en mesurant l'augmentation de pression due à l'apparition de H2 gazeux. Les quantités introduites sont : V0=50,0 mL d'une solution d'acide chlorhydrique à c= 0,50 mol/L ; m0 = 0,0194 g de magnésium bien décapé. Pourquoi est-il nécessaire de décaper le magnésium ? Eliminer la couche d'oxyde protectrice afin de mettre le métal à nu. L'acide chlorhydrique est commercialisé en solution aqueuse à 37 % en masse. La densité de cette solution est d=1,19. La masse molaire de HCl est 36,46 g/mol. Déterminer le volume v de la solution commerciale à prélever pour préparer 1,0 L de solution d'acide chlorhydrique à 0,50 mol/L. Masse de 1 L de solution commerciale : 1,19 kg ou 1190 g. Masse d'acide chlorhydrique pur dans 1 L de solution commerciale : 1190*0,37 =440,3 g Quantité de matière d'acide chlorhydrique : 440,3 / 36,46 = 12,1 mol dans 1 L. Facteur de dilution : 12,1 / 0,5 = 24,2 Volume de solution commerciale à prélever : 1 / 24,2 = 0,0414 L ~ 41 mL. 41 mL de la solution
commerciale sont mésurés à
l'aide d'une burette graduée. Rincer la
burette à l'eau distillée. Verser dans une fiole
jaugée de 1 L contenant un peu d'eau
distillée. Compléter jusqu'au
trait de jauge avec de l'eau distillée ;
agiter pour rendre homogène.
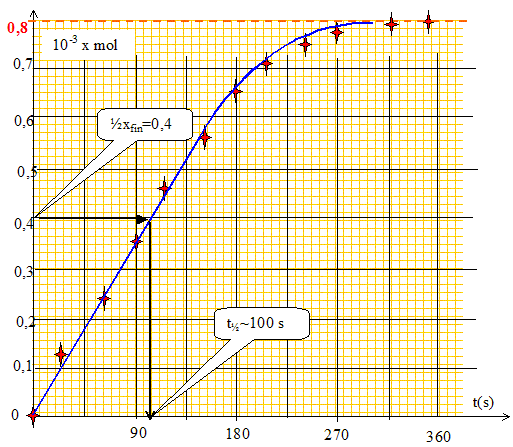
Donner l'expression de l'avancement x en fonction de DP, R, T et V, puis en fonction de xmax, DP, DPmax. x = nH2 =DP V / (RT) ; xmax =DPmax V / (RT) ; x/ xmax =DP / DPmax ; x= xmaxDP / DPmax. On obtient les résultats suivants : compléter le tableau.
Tracer la courbe x(t) et déterminer le temps de demi-réaction.
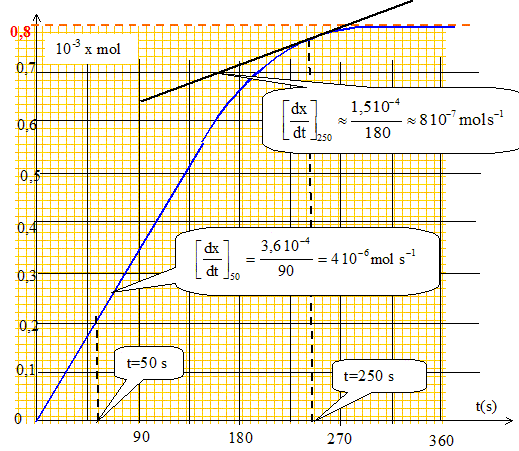
Définir mathématiquement la vitesse de la réaction ( mol s-1). La déterminer graphiquement à t = 50 s et à t = 250 s. v = 1/V0 dx/dt.
On détermine graphiquement [dx/dt]t=50 et [dx/dt]t=250 en calculant le coefficient directeur de la tangente à la courbe ci-dessus à t =50 s puis à t = 250 s. V0 = 0,05 L ; v50 = 4 10-6/0,05 = 8 10-5 mol L-1 s-1 ; v50 = 8 10-7/0,05 = 1,7 10-5 mol L-1 s-1. Comment la vitesse de la raction évolue t-elle au cours du temps ? Du fait de la diminution de la quantité de matière des réactifs, la vitesse décroît au cours du temps.
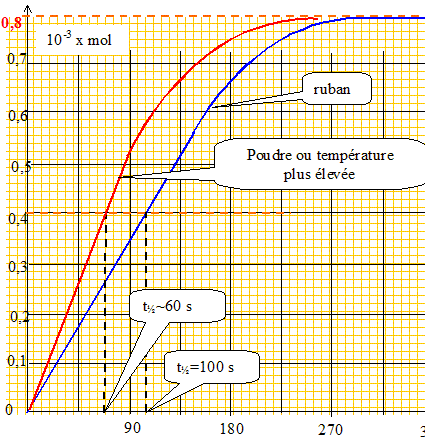
Influence de certains paramètres. Si on avait utilisé la même masse de magnésium que précédemment mais sous forme de poudre fine, la valeur du temps de demi-réaction aurait-elle été plus grande ou plus petite que dans l'expéreince précédente ? Justifier. La réaction est d'autant plus rapide que la surface de contact entre le magnésium et l'acide est plus grande : avec une poudre, la réaction est plus rapide qu'avec un ruban. La valeur du temps de demi-réaction est donc plus petite. Même question si on avait placé le ballon dans un cristallisoir d'eau chaude. La réaction est d'autant plus rapide que la température est plus grande : la température est un facteur cinétique. La valeur du temps de demi-réaction est donc plus petite.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|