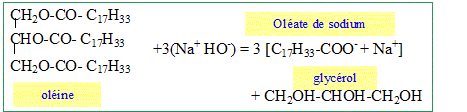|
Savon de Marseille, triglycérides, indice d'iode, hydrogénation En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
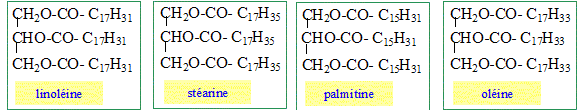
L'huile d'olive contient 15% de palmitine, 5% de stéarine, 52% d'oléine et 28% de linoléine. Ecrire la formule semi développée de la palmitine, de la stéarine, de l'oléine, et de la linoléine. acide palmitique : C16H32O2 : CH3-(CH2)14-COOH. acide stéarique : C17H34O2 : CH3-(CH2)15-COOH. acide oléique : CH3-(CH2)7-CH=CH-(CH2)7-COOH. acide linoléique : CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH.
De quelle famille chimique fait partie l'oléine. Triglycérides Ecrire l'équation de saponification de l'oléine (espèce majoritaire de l'huile d'olive). Nommer les différentes espéces chimiques.
On fabrique 100 kg de savon. Quelle quantité d'oléine est nécessaire ? Masse molaire de l'oléate de sodium : M(savon) = 18*12+33+32+23=304 g/mol Quantité de matière de savon (mol) = masse (g) / masse moalire (g/mol) n(savon )= 100 000 / 304 =329 mol d'après les coefficients de l'équation : n( oléine) = n(savon) / 3 = 329 /3 = 109,7 mol Masse molaire de l'oléine : C57H104O6 : M(oléine) = 57*12+104+6*16 = 884 g/mol. masse d'oléine : n(oléine) * M'oléine) = 109,7*884 = 96,9 kg.
On réalise l'addition de 200g d'hydrogène sur l'oléine. Ecrire l'équation de la réaction d'hydrogénation. L'acide oléique compte une seule double liaison éthylénique ; l'oléine compte donc trois doubles liaisons éthyléniques. C57H104O6 + 3H2 = C57H110O6 Quel est le produit obtenu ? La stéarine. Quelle est la masse de produit obtenu ? Quantité de matière de dihydrogène (mol) = mase (g) / masse molaire H2(g/mol) n(H2) = 200 /2 = 100 mol. D'après les coefficients de l'équation : n(stéarine) = n(H2)/3 = 100/3 = 33,33 mol. Masse molaire de la stéarine : M(stéarine) = 57*12+110+6*16 = 890 g/mol. masse de stéarine = n(stéarine)*M(stéarine) m= 33,33*890 = 29,7 kg. L'indice de diiode de l'huile d'olive est d'environ 80. Vérifier cet indice. Ecrire les équations de réactions correspondantes. L'oléine compte 3 doubles laisons éthyléniques et peut fixer trois mole d'iode. C57H104O6 + 3I2 = C57H104I6O6 (1) La linoléine compte 6 doubles laisons éthyléniques et peut fixer 6 mole d'iode. C57H98O6 + 6I2 = C57H98I12O6 (2) La stéarine et la pamitine étant saturées ne fixent pas de diiode. Dans 100 g d'huile d'olive il y a 52 g d'oléine soit 52/884 = 5,88 10-2 mol (1) donne la quantité de matière de diiode fixé : 3*5,88 10-2 =0,176 mol Dans 100 g d'huile d'olive il y a 28 g de linoléine soit 28/878 = 3,19 10-2 mol (2) donne la quantité de matière de diiode fixé : 6*3,19 10-2 =0,191 mol Quantité de matière totale de diiode : 0,191+0,176 = 0,367 mol M(I2) = 254 g/mol masse de diiode : 254*0,367 = 93.
|
|||||||
|
|
|||||||
|
|