|
De l'importance de l'eau oxygénée : électrolyse d'une saumure, cinétique ( bac S Liban 2009) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
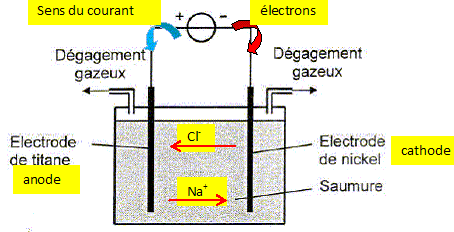
On donne : couples oxydant / réducteur : Cl2(g) / Cl- aq ; H+aq / H2(g). NA = 6,02 1023 mol-1 ; e = 1,60 10-19 C ; Vm = 30,0 L mol-1. Le dihydrogène nécessaire à la synthèse de l'eau oxugénée H2O2 (liq) doit être très pur. Il est obtenu par électrolyse d'une saumure, solution concentrée de chlorure de sodium ( Na+aq + Cl-aq). Identifier cathode et anode ; indiquer le sens de déplacement des différents porteurs de charge.
Les cations présents en solution ( H+aq) se déplacent comme les ions Na+aq ; les anions présents en solution ( HO-aq) se déplacent comme les ions chlorure. Ecrire les
demi-équations des réactions se
produisant aux électrodes. anode, oxydation des ions chlorures :
2Cl-aq = Cl2(g) +
2e-. cathode, réduction de
H+aq (ou de l'eau ):
2H+aq +2e- =
H2(g). Exprimons de deux manière différentes la quantité d'électricité notée Q : Q = IDt avec I en ampère, Dt en seconde et Q en coulomb (C). La charge, en valeur absolue d'une mole d'électrons est égale à NA e ; la charge, en valeur absolue de n(e-) moles d'électrons est : n(e-)NA e. Par suite : Q = IDt = n(e-)NA e. (1) Or 2H+aq +2e- = H2(g) ; les coefficients stoechiométriques conduisent à : n(H2) = ½n(e-). Enfin volume de dihydrogène (L)= quantité de matière de dihydrogène (mol) fois volume molaire des gaz ( L/mol) VH2 =n(H2) Vm = ½n(e-) Vm ; n(e-) = 2 VH2 / Vm ; repport dans (1) : IDt = 2 NA e VH2 / Vm ; VH2 = I Dt Vm / ( 2 NA e). L'intensité du courant vaut I= 5,00 104 A. Calculer le volume de dihydrogène produit par heure de fonctionnement. VH2 = 5,00 104 * 3600*30,0 / (2*6,02 1023*1,60 10-19) =2,80 104 L = 28,0 m3.
Cinétique de la dismutation de l'eau oxygénée. La solution aqueuse d'eau oxygénée se décompose lentement en dioxygène O2(g) et en eau : 2 H2O2 (aq) = O2 (g) + H2O(liq). On veut effectuer le suivi cinétique de cette réaction supposée totale à 25 °C. La décomposition de l'eau oxygénée étant très lente, celle-ci doit être catalysée par les ions fer (III) Fe3+ aq. A l'instant t=0, on mélange : - V = 24 mL de solution aqueuse d'eau oxygénée de concentration molaire en soluté apporté c = 2,5 mol/L - 6,0 mL de solution aqueuse de chlorure de fer (III) Fe3+ aq + 3 Cl-aq. - de l'eau distillée jusqu'à obtenir une solution de volume total VT= 1,0 L, supposé rester constant au cours du temps. Un dispositif permet de recueillir
et de mesurer le volume de dioxygène VO2
dégagé à la pression
atmosphérique P = 1,013 105
Pa. Compléter le tableau d'avancement suivant :
La réaction étant totale : 0,060-2xmax = 0 ; xmax =0,060/2 = 0,030 mol.
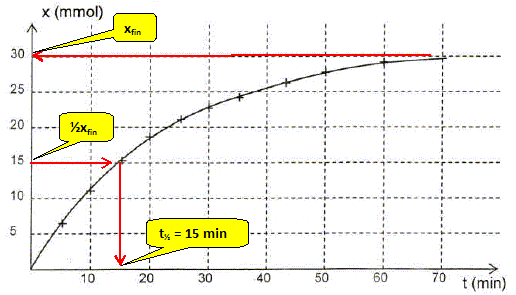
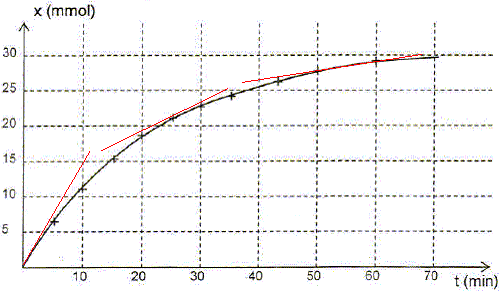
Etablir l'expression de l'avancement x(t) de la réaction en fonction du volume de dioxygène VO2(t) formé. Calculer sa valeur à t = 30 min . La quantité de matière d'un gaz est égale au volume (L) du gaz divisée par le volume molaire des gaz Vm ( L/mol) ( volumes mesurés dans le mêmes conditions de température et de pression ). x(t) = VO2(t) / Vm ; VO2(30) = 540 mL = 0,540 L ; x(t=30) =0,540 / 30,0 = 0,0180 mol. On donne le graphe donnant l'avancement x en fonction du temps. Définir le temps de demi réaction t½ et déterminer graphiquement sa valeur. Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
Quelle information le graphe x(t) donne t-il sur l'évolution de la vitesse de la réaction au cours du temps ? Justifier. v = 1/Vtot dx/dt avec Vtot = constante. dx/dt est égal au coefficient directeur de la tangente à la courbe à la date t ; or les tangentes sont de moins en moins inclinées par rapport à l'horizontale quand le temps augmente. Donc dx/dt diminue et en conséquence la vitesse de la réaction diminue au cours du temps.
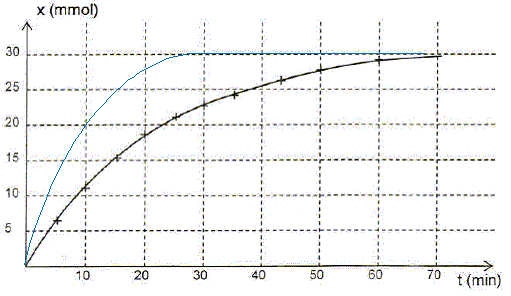
Dire si les propositions suivantes sont vraies ou fausses en justifiant. Le mélange initial est complété avec de l'eau distillée afin que V'tot = 0,50 L. - proposition 1 : l'avancement final est divisé par 2. Faux. La quantité de matière d'eau oxygénée reste inchangée : l'avancement final ne change donc pas. - proposition 2 : l'état final est atteint plus rapidement. Vrai. V'tot = ½VT et la quantité de matière d'eau oxygénée reste inchangée : la concentration initiale de l'eau oxygénée est donc deux fois plus élevée. Or la concentration d'un réactif est un facteur cinétique : la vitesse de la réaction va augmenter et l'état d'équilibre sera donc plus rapidement atteint. Rappeler la définition d'un catalyseur. Un catalyseur augmente la vitesse d'une réaction thermodynamiquement possible. Il peut, dans certain cas orienter une réaction si deux issues sont possibles. Il n'apparaît pas dans le bilan, étant régénéré en fin de réaction. Lors de ce suivi cinétique, la catalyse mise en jeu est-elle homogène ou hétérogène ? Justifier. Le catalyseur est un ion en solution aqueuse ; l'eau oxygénée est en solution aqueuse. Le catalyseur et le réactif appartiennent à la même phase : la catalyse est homogène.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|