|
Chimie à usage domestique : DesTop, savon bac S Nouvelle Calédonie 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Analyse d'un déboucheur de canalisations domestiques. Le DesTop est un produit ménager qui permet de déboucher les canalisations. Sur l'étiquette on trouve les indications suivantes : - contient de l'hydroxyde de sodium en solution ; 20 % en masse ; n'attaque pas l'émail ; dissout toute matière organique. La solution commerciale Sc, de concentration Cc, étant trop concentrée, on la dilue 100 fois. On obtient une solution, notée S, d'apparence incolore. Titrage en présence d'un indicateur coloré de la solution diluée S. On considère, pour simplifier, que le DesTop est uniquement constitué d 'une solution aqueuse d'hydroxyde de sodium ( Na+ + HO-). On prélève un volume V = 50,0 mL de la solution S que l'on verse dans un erlenmeyer. On y ajoute quelques gouttes d'indicateur coloré, le bleu de bromothymol( BBT). On dose par de l'acide chlorhydrique ( H+ + Cl-), de concentration CA =0,20 mol/L. Il faut verser un volume VE = 15,0 mL d'acide chlorhydrique pour observer le changement de couleur de l'indicateur coloré. Données : couples acide / base H3O+(aq)/ H2O(l) ; H2O(l) / HO-(aq) Bleu de bromothymol : teinte acide : jaune ; teinte basique : bleue dans la zone de virage ( 6<pH <7,6) le BBT prend une teinte verte. Masse molaire de l'hydroxyde de sodium M = 40,0 g/mol ; masse volumique du DesTop : r = 1,20 g mL-1. Ecrire l'équation de la réaction associée à la transformation chimique qui se produit lors du titrage. couples acide / base H3O+(aq)/ H2O(l) ; H2O(l) / HO-(aq) H3O+(aq) + HO-(aq) = 2 H2O(l). Donner l'expression littérale puis calculer la valeur de la constante d'équilibre, notée K1, associée à la réaction.
A l'équivalence les
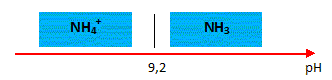
quantités de matière des
réactifs mis en présence sont en
proportions stoechiométriques. Avant
l'équivalence, l'un des réactifs est
en excès ; après
l'équivalence, l'autre réactif est en
excès. Quantité de
matière d'ion oxonium
n(H3O+(aq))
= CAVE. Quantité de
matière d'ion hydroxyde
n(HO-(aq))
= CV. A l'équivalence :
CAVE = CV. Avant l'équivalence, la solution de l'erlenmeyer prend une teinte bleue ( soude en excès) Après l'équivalence, la solution de l'erlenmeyer prend une teinte jaune ( acide en excès) On repère l'équivalence lors du changement de teinte de l'indicateur coloré. Calculer la concentration CC à partir des information du texte ci-dessus et comparer avec le résultat du dosage. "masse volumique du DesTop : r = 1,20 g mL-1" : la masse de 1 L de DesTop est 1200 g " 20 % en masse" ; elle contient : m =1200*0,20 = 240 g d'hydroxyde de sodium "Masse molaire de l'hydroxyde de sodium M = 40,0 g/mol " : n = m/M= 240/40 = 6 mol. CC = 6,0 mol/L. ( accord avec le résultat du dosage) Présence d'ammoniac dans le DesTop. En réalité la solution commerciale ne contient pas que de l'hydroxyde de sodium. Quand on ouvre prudemment une bouteille de DesTop, il se dégage notamment, une odeur d'ammoniac. Données : ion ammonium / ammoniac NH4+ / NH3 Ka = 6,3 10-10 ou pKa = 9,2 à 25°C. Masse molaire de l'ammoniac : M = 17 g/mol. Ecrire l'équation de la réaction entre l'ammoniac NH3 et les ions oxonium apportés par l'acide chlorhydrique lors du titrage. Couples acide / base : NH4+ (aq)/ NH3 (aq) et H3O+(aq)/ H2O(l) H3O+(aq) + NH3 (aq) = H2O(l) + NH4+ (aq). Donner l'expression littérale puis calculer la valeur de la constante d'équilibre, notée K2, associée à la réaction.
..
Tracer le diagramme de prédominance du couple NH4+ / NH3 .
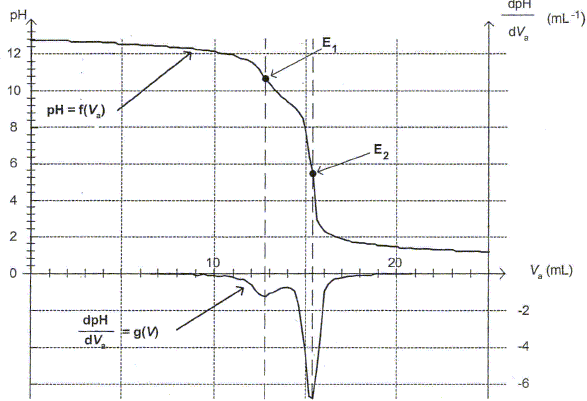
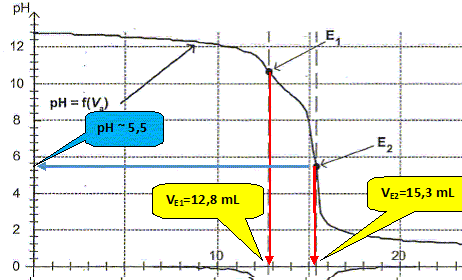
Titrage pHmétrique de la solution diluée de DesTop. On souhaite connaître la composition quantitative du DesTop en ammoniac et en hydroxyde de sodium. On procède alors à un titrage pHmétrique, réalisé dans les conditions de l'expérience précédente, permettant de déterminer les concentrations molaires volumiques de l'ammoniac et des ions hydroxyde en solution. Un logiciel permet de tracer les courbes pH=f(Va) et dpH/dVa = g(Va).
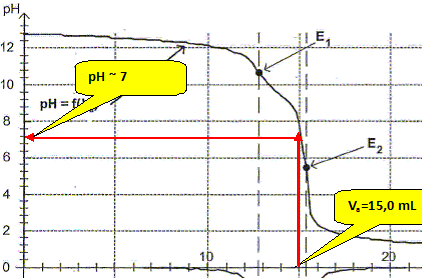
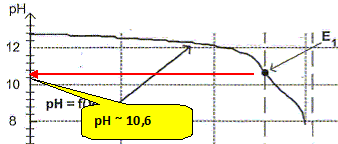
Justifier, à l'aide de la figure, le fait que l'indicateur coloré de l'expérience précédente a changé de couleur pour un volume Va = 15,0 mL.
Le pH du point équivalent appartient à la zone de virage [6 ; 7,6] de l'indicateur coloré.
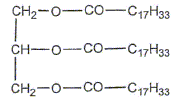
Obtention d'un savon : Synthèse d'un savon au laboratoire. Dans un ballon, on introduit 10 mL de solution aqueuse d'hydroxyde de sodium, 5 mL d'éthanol, 20 mL d'huile d'olive et quelques grains de pierre ponce. On chauffe à reflux pendant 30 minutes. On verse le mélange obtenu dans de l'eau salée froide, un précipité blanc jaune apparaît. L'huile d'olive contient essentiellement l'oléine.
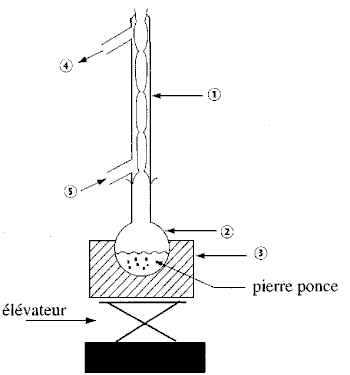
Faire un montage annoté du montage utilisé pour fabriquer le savon. l'eau entre en (5) et sort en (4)
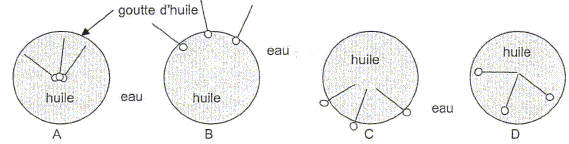
Propriétés du savon. Donner les définitions des mots hydrophile et hydrophobe. Hydrophile : ami de l'eau, qui a une affinité pour l'eau. Hydrophobe : ennemi de l'eau, qui n'a pas d'affinité pour l'eau. L'ion carboxylate du savon peut être représenté de la façon suivante ----------O dans lequel la partie rectiligne représente la chaîne carbonée et le cercle le groupe carboxylate. Indiquer la partie hydrophile et la partie hydrophobe. partie hydrophile : groupe COO- symbolysé par "O" et partie hydrophobe de cet ion : la chaîne carbonée symbolysée par "---------". Choisir parmi les schémas ci-dessous, celui qui montre comment se positionnent les ions carboxyliques à la surface d'une goutte d'huile en suspension dans l'eau. Justifier.
La chaine carbonée hydrophobe ( lipophile) se fixe dans l'huile ; la tête hydrophile se situe dans l'eau : schéma C.
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|