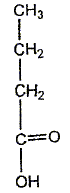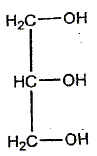|
Un constituant du beurre ( bac S Nlle calédonie mars 2009) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
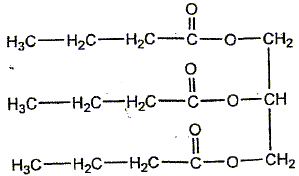
Le chimiste français T.J. Pelouze fût le premier, au XIX ème siècle, à décrire la synthèse d'un triglycéride : la butyrine (notée E dans tout l'exercice), principal constituant du beurre. Le texte ci-dessous est inspiré de son mémoire, paru dans les Annales de Chimie et Physique, en 1844 : L'acide butyrique (ou acide butanoïque) a été découvert en 1814, parmi les produits de la saponification du beurre, par M. Chevreul, qui en a décrit l'histoire avec beaucoup de soin dans son ouvrage sur les corps gras d'origine animale. […] Nous nous bornerons aujourd'hui à présenter quelques observations relatives à l'action de l'acide butyrique sur la glycérine. (1) Lorsqu'on chauffe légèrement un mélange de ces deux substances et d'acide sulfurique concentré et qu'on le verse ensuite dans une grande quantité d'eau, on voit aussitôt se séparer de la solution aqueuse une huile liquide légèrement jaunâtre notée (E). On peut laver cette huile avec de grandes quantités d'eau car elle est peu soluble dans l'eau. (2) Si on mélange à chaud cette matière grasse (E) avec une solution concentrée de potasse caustique, on en retire du butanoate de potassium et de la glycérine Données : La potasse caustique est une solution aqueuse d'hydroxyde de potassium (K+ + HO-) Masse molaire de la butyrine : M1 = 302 g / mol ; masse molaire du butanoate de potassium : M2 = 126 g / mol.
À chaque affirmation a., b., etc., répondre par " VRAI " ou " FAUX ". Toute réponse " VRAI " doit être accompagnée de justifications ou de commentaires brefs (définitions, calculs, exemples ou contre-exemples, connaissances de cours …).
A-
estérification
(vrai) B- hydrolyse
(faux) L'action de l'acide butyrique sur la
glycérine ( un trialcol) conduit a un
triester. A- limitée (vrai) B- rapide (faux) L'estérification est limitée par l'hydrolyse de l'ester. Lors de la transformation décrite dans l'étape (1), l'acide sulfurique joue le rôle de : A- solvant (faux) B- réactif (faux) C- catalyseur.(vrai) Les ions oxonium apportés par l'acide sulfurique jouent le rôle de catalyseur. Ils accélèrent à la fois l'estérification et l'hydrolyse. Un catalyseur n'apparaît pas dans le bilan réactionnel.
Le chauffage utilisé dans l'étape (1) permet de : A- homogénéiser le milieu réactionnel (faux) B- augmenter le rendement (faux) C- accélérer la transformation (vrai) La température est un facteur cinétique. L'équilibre est atteint plus rapidement ; la composition du mélange à l'équilibre n'est pas modifiée. Pour séparer l'huile obtenue dans l'étape (1) de la solution aqueuse, on peut utiliser : A- une filtration sur Büchner (faux) B- une ampoule à décanter (vrai) C- une filtration sur papier filtre. (faux) L'ampoule à décanter permet la séparation de deux liquides non miscibles, l'huile et la phase aqueuse.
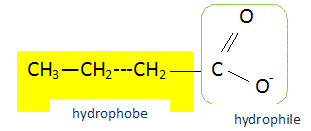
La transformation citée dans l'étape (2) est une : A- estérification (faux) B- hydrolyse basique d'un ester (faux) C- réaction acide-base (faux) D- saponification (vrai) On mélange à chaud un triester avec une solution concentrée de potasse caustique : on en retire un savon, le butanoate de potassium et de la glycérine.
si la potasse est en défaut : 0,15-3xmax =0 ; xmax =0,050 mol.
|
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
|