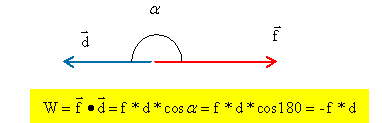|
Oxydoréduction: eau oxygénée , acide base, énergie cinétique bac physique chimie St2S 2009. |
||||||||||||||||
|
||||||||||||||||
|
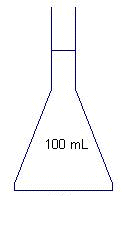
La préparation ( 6,5 points) Après avoir choisi l'habillement, Julia prépare la trousse "premiers secours" dans laquelle elle met l'indispensable pour soigner les petites blessures. Elle prend au fond de l'armoire à pharmacie une bouteille d'eau oxygénée à 10 volumes qui fera office d'antiseptique. Mais la date de péremption est dépassée. Pour savoir si l'eau oxygénée est encore efficace, ulia décide d'aller au lycée pour la doser. Préparation du dosage : Pour doser correctement le peroxyde d'hydrogène contenu dans l'eau oxygénée Julia doit diluer 10 fois la solution de la bouteille ( solution mère). Elle souhaite obtenir un volume V = 100 mLde solution diluée ( solution fille). De la verrerie de laboratoire est mise à sa disposition : - pipettes jaugées ; fioles jaugées ; becher ; éprouvettes graduées. Parmi le matériel disponible choisir et dessiner :
- le récipient dans lequel on effectue la dilution
par ajout d'eau distillée.
Fiole
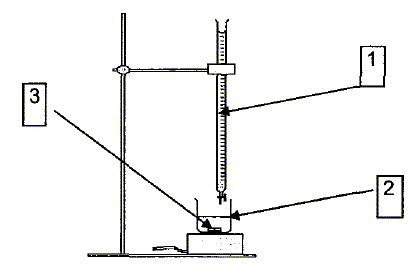
jaugée. La solution titrante est une solution de permanganate de potassium ( K+ + MnO4-). Pour obtenir 0,25 L de solution, le préparateur doit dissoudre une quantité de matière de permanganate de potassium n = 5 10-3 mol. Calculer la masse m de permanganate de potassium que le préparateur doit peser pour préparer cette solution. La masse molaire du permanganate de potassium est M = 158 g/mol. m = n M =5 10-3 *158 = 0,79~ 0,8 g. Le dosage. On doe V2 = 10 mL de solution d'eau distillée diluée. Donner les noms des différentes parties du dispositif de dosage représenté ci-dessous. 1 : burette graduée ; 2 : becher ; 3 :
turbulent ( petit aimant) MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (1) O2 + 2H+ + 2e- =H2O2 (2) A partir de ces deux demi-équations, recopier et compléter l'équation de la réaction du dosage donnée ci-dessous: MnO4- + ....H2O2 +.......H+ --> ..... +......+ ........ 2 fois (1) : 2MnO4- + 16H+ + 10e- = 2Mn2+ + 8H2O 5 fois (2) écrire en sens inverse : 5 H2O2 =5O2 + 10H+ + 10e- . Ajouter : 2MnO4- + 16H+ + 10e- + 5 H2O2 = 2Mn2+ + 8H2O +5O2 + 10H+ + 10e- . Simplifier : 2MnO4- + 6H+ + 5 H2O2 = 2Mn2+ + 8H2O +5O2 . Julia obtient l'équivalence lorsqu'elle a versé un volume V1E = 8,0 mL de solution de permanganate de potassium à la concentration c1 = 2,0 10-2 mol/L. Définir l'équivalence d'un dosage. A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. A partir de la réaction du dosage montrer que l'on peut écrire la relation suivante : c2V2 / 5 = c1 V1E/2, c2 est la concentration en peroxyde d'hydrogène de la solution diluée. Quantité de matière (mol) des réactifs = concentration ( mol/L)*volume (L) n(MnO4- ) = c1 V1E ; n(H2O2) = c2 V2 ;
Calculer c2. c2 =5c1 V1E / (2V2 ) = 5*2,0 10-2 *8 / (2*10) = 4,0 10-2 mol/L. Julia trouve que la concentration en proxyde d'hydrogène de l'eau oxygénée présente dans la bouteille avant dilution est c = 0,40 mol/L. Calculer son titre en volume. 11,2 c = 11,2 *0,40 = 4,5 volumes. Au vu du résultat, plus de deux fois plus petit que les indications inscrites sur la bouteille, Julia décide de racheter une nouvelle bouteille d'eau oxygénée et la randonnée commence....
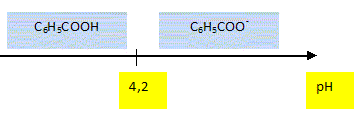
Arrêt au gîte (5,5 points) Après plusieurs heures de pédalage sous la pluie, le groupe décide de s'arrêter déjeuner dans une auberge. Il y a sur la table une bouteille d'eau et un soda. Le pH de l'eau minérale indiqué sur l'étiquette est 6,3. Montrer que la concentration en ion oxonium [H3O+] de cette eau minérale est voisine de 5,0 10-7 mol/L? [H3O+] = 10-pH = 10-6,3 =5,0 10-7 mol/L. Calculer la quantité de matière d'ion oxonium contenue dans cette bouteille de volume V = 1,5 L. n = c V = 5,0 10-7 * 1,5 = 7,5 10-7 mol. Sur l'étiquette du soda on peut lire, entre autres, : conservateur : benzoate de sodium. L'ion benzoate C6H5-COO- est une base, il fait partie du couple " acide benzoïque / ion benzoat" dont le pKa est 4,2. Donner la dfinition d'une base selon Brönsted. Espèce, ion ou molécule susceptible de gagner un proton H+. Ecrire la réaction susceptible de se produire entre l'ion benzoate et l'eau. Nommer les produits obtenus. C6H5-COO- + H2O = C6H5-COOH + HO-. acide benzoïque et ion oxonium. Donner l'expression littérale de la constante d'acidité du couple acide benzoïque / ion benzoate. Ka =[C6H5-COO-] [H3O+] / [C6H5-COOH] Le pKa de ce couple est 4,2. Représenter sur un axe gradué en pH, le diagramme de prédominance de l'acide benzoïque et de l'ion benzoate.
Le pH de l'estomac est égal à 2. En s'aidant du diagramme précédent, dire ce qu'il advient de l'ion benzoate lorsque Rémi a avalé la boisson. Dans l'estomac, à pH inférieur au pKa, la forme acide benzoïque prédomine. Le repas étant très copieux, le restaurateur propose à rémi une boisson facilitant la digestion en oubliant de lui dire qu'elle contient de l'alcool. Rémi accepte....
Energie cinétique. ( 8 points) Les deux compères reprennent leur vélo et entament une descente sur une route désaffectée toujours mouillée. A la fin de la descente, la route est horizontale, mais il y a un affaissement de chaussée. Rémi décide de sauter par dessus le trou, il prend donc de la vitesse, mais arrivé sur la partie horizontale, il se ravise et frine au maximum pour s'arêter avant l'affaissement. Il parcourt toute la partie horizontale en dérapant.
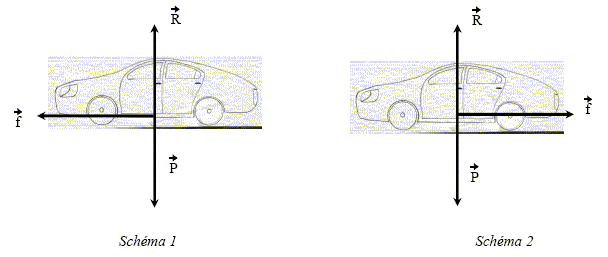
f représente l'ensemble des forces de frottement, F1 est la réaction de la route. Nommer la force F2. Le poids de Rémi. Donner l'expression littérale du travail de la force F2 sur le trajet AB.
Schéma n°1 : la force f et la vitesse ont le même sens : l'effet de cette force est l'augmentation de la vitesse. Schéma n°2 : les vecteurs force f et vitesse sont colinéaires de sens contraire : l'effet de cette force est la diminution de la vitesse du véhicule.
|
||||||||||||||||
|
|
||||||||||||||||
|
|