|
Oxydoréduction: eau oxygénée, les acides gras, l'iode radioactif bac physique chimie St2S Antilles 2009. |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
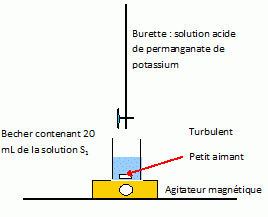
Pour entretenir ses lentilles,Emma utilise le produit "CLEAN 3 en 1"dont voici la notice : Description du système «CLEAN 3 en 1» : c'est un système qui permet, en toute sécurité l'entretien des lentilles. Chaque coffret «CLEAN 3 en 1» contient :- une solution oxydante nommée S contenant une solution de peroxyde d'hydrogène (H202) à environ 3% ; - un comprimé dit «de neutralisation» contenant de la catalase. Composition : 1 mL de solution oxydante contient environ 30 mg de peroxyde d'hydrogène. Précautions particulières d'utilisation : La solution Spossède une durée de conservation limitée. (Voir date de péremption au dos de la boîte). Ne jamais mettre la solution S directement dans l'oeil, ni poser directement sur les yeux les lentilles prélevées dans la solution «non neutralisée». Dans un tel cas, retirer immédiatement les lentilles et rincer abondamment les yeux à l'eau courante. PARTIE A : On se propose de vérifier la composition en peroxyde d'hydrogène de la solution commerciale S « non neutralisée ». On veut préparer 100,0 mL de solution S1 en diluant 20 fois la solution commerciale S. Nommer le matériel nécessaire pour réaliser cette dilution. Fiole jaugée de 100,0 mL 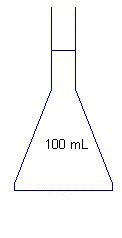 et pipette jaugée de : 100/20 = 5,0 mL.  Dans un bécher n° 1, on introduit V1 = 20,0 ml de solution S1. La solution aqueuse de peroxyde d'hydrogène est dosée par une solution de permanganate de potassium acidifiée de concentration molaire C2= 2,00 x10-2 mol.L". Faire le schéma annoté du dispositif de dosage.
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (1) O2 + 2H+ + 2e- =H2O2 (2) Quels sont les réactifs ? Ecrire l'équation d'oxydoréduction correspondant au dosage. 2 fois (1) : 2MnO4- + 16H+ + 10e- = 2Mn2+ + 8H2O 5 fois (2) écrire en sens inverse : 5 H2O2 =5O2 + 10H+ + 10e- . Ajouter : 2MnO4- + 16H+ + 10e- + 5 H2O2 = 2Mn2+ + 8H2O +5O2 + 10H+ + 10e- . Simplifier : 2MnO4-
+ 6H+ + 5 H2O2 = 2Mn2+ + 8H2O
+5O2 . Etude de l'équivalence. Définir l'équivalence d'un dosage. A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. Montrer qu'à l'équivalence, la
relation entre la quantité de matière n1 de peroxyde
d'hydrogène présent dans 20,0 ml de solution S1et la
quantité de matière n2 d'ions
Quantité de matière (mol) d'ion permanganate = concentration ( mol/L)*volume (L) n(MnO4- ) = c2 VE =2,00 10-2 * 18,0 10-3 =3,60 10-4 mol. Montrer que n1est égale à 9,00 x 10-4 mol. n1 =2,5 n2 = 2,5 *
3,6 10-4 =9,00 10-4 mol. En accord avec la notice. PARTIE B: On étudie à présent l'action du comprimé dit «de neutralisation» sur la solution commerciale S d'entretien des lentilles. Une solution aqueuse de peroxyde d'hydrogène se décompose lentement au cours du temps en dioxygène et en eau selon l'équation : 2 H202---> O2 + 2 H20. Dans un bécher n°2,on introduit 20,0 ml de solution S et on ajoute le comprimé de «. neutralisation ». Des bulles apparaissent à la surface. La seule réaction se produisant étant celle de décomposition du peroxyde d'hydrogène, préciser le nom de l'espèce chimique contenue dans les bulles. Le dioxygène. On constate que le bécher n°2contient moins de peroxyde d'hydrogène que le bécher n°1. En déduire le rôle de la catalase contenue dans le comprimé de «neutralisation». La catalase accélère la réaction de décomposition de l'eau oxygénée : la catalase est un catalyseur. Comment évolue l'efficacité de «ClEAN 3 en 1» au cours du temps? Expliquer pourquoi Emma doit être attentive à la date de péremption indiquée sur l'emballage. Au cours du temps la solution de peroxyde d'hydrogène se décompose en dioxygène et en eau : la quantité de peroxyde d'hydrogène diminue et la solution est de moins en moins efficace. A partir de la date de péremption, toute l'eau oxygénée s'est décomposée et la solution n'est plus efficace.
Des acides gras : les oméga 3 (5,5 points) «L'analyse
des résultats de 13 études portant sur plus de 222 000 personnes
suivies pendant douze ans en moyenne prouve que les personnes qui
consomment un plat de poisson par semaine voient leur risque de
mortalité cardio-vasculaire réduit de 15%. Ce risque est même réduit de
40% chez ceux qui en consomment cinq. Un bénéfice attribué aux acides
gras oméga 3 qui préviennent les arythmies, font baisser les
triglycérides et pourraient même entraîner une perte de graisses
corporelles, selon une étude australienne qui s'est intéressée, pendant
douze semaines, à 75 adultes en surpoids.» L'acide alpha-Iinolénique a pour formule C17H29- COOH. Recopier la formule de l'acide alpha-linolénique. Entourer et nommer le groupe caractéristique. -COOH : groupe acide carboxylique. Cet acide est-il saturé ou insaturé? Justifier. C17H29- : à partir de 17 atomes de carbone une chaîne carbonée saturée compte 17*2+1 = 35 atomes d'hydrogène. Le nombre d'hydrogène étant inférieur à 35, la chaîne carbonée est insaturée. Le texte fait aussi référence aux triglycérides, qui, comme les acides gras, entrent, par exemple, dans la composition des huiles. L'équation de la réaction de formation du triglycéride, noté D, obtenu à partir de l'acide alpha-linolénique et du glycérol s'écrit : 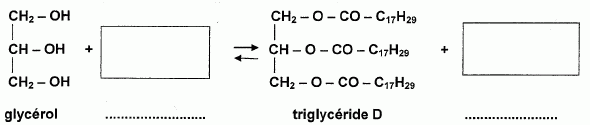 Recopier, compléter cette équation en indiquant les formules et les noms des composés manquants et en ajustant les nombres stoechiométriques. A quelle famille appartient le composé D ? Entourer le groupe fonctionnel correspondant. 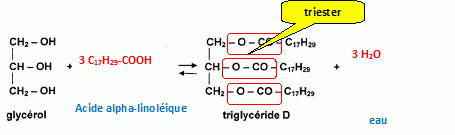 Quel est le nom donné à cette réaction? Indiquer deux caractéristiques de cette réaction. L'estérification est lente et limitée par l'hydrolyse de l'ester. Ce triglycéride étant insaturé il est possible de l'hydrogéner pour le transformer en graisse, notée E. L'équation d'hydrogénation correspondante est la suivante: D + 9 H2 ~ E On fait réagir une masse m0 de triglycéride D égale à 456 g. Montrer que la quantité de triglycéride D correspondante est n0 = 0,523mol. Données: masse molaire du triglycéride D : MD= 872 g /mol. n = m /M =m0 /MD= 456 / 872 =0,523 mol. A l'aide de l'équation de la réaction d'hydrogénation, montrer que la quantité nE de graisse E que l'on doit obtenir est égale à 0,523mol. Une mole de D conduit à une mole de E. 0,523 mole de D conduit à 0,523 mole de E. En déduire la masse de graisse E correspondante. Données: masse molaire du composé E : ME= 890 g/mol. m = n M = nE ME =0,523*890 =465,4 ~ 465 g. En réalité, le rendement est de 94,0 %. Quelle masse de graisse E obtient-on ? 465,4*0,94 = 437 g.
L'IODE NATUREL ET L'IODE RADIOACTIF (6,5 points) L'apport d'iode est essentiel à l'organisme humain : la glande thyroïde capte l'iode sous forme d'ions iodure et les utilise pour synthétiser les hormones thyroïdiennes. L'iode ne possède qu'un seul isotope naturel : l'iode 12753I qui est non radioactif. Par contre, l'un de ses isotopes artificiels, l'iode 131,est radioactif. Il est présent lors de tout incident nucléaire. Donner le nom des différents constituants du noyau de 12753I. Préciser leur nombre. 53 protons et 127-53 = 74 neutrons. Définir le mot «isotope». Deux isotopes ont le même nombre de protons mais des nombres de neutrons différents. Quelle glande fixe l'iode dans le corps humain ? Se produit-il une transformation chimique ou nucléaire ? La thyroïde fixe l'iode dans le corps humain. Il se produit une réaction chimique.
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|