|
chimie organique : analyse d'un protocole, double extraction ou simple extraction concours chimie agrégation 2008.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
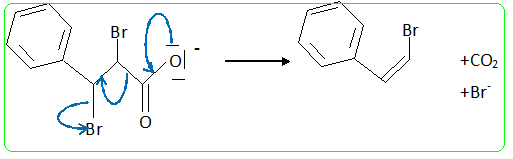
L'acide dibromo-2,3 phényl-3 propanoïque est soumis à une réaction d'élimination- décarboxylation sous l'influence d'un agent alcalin, le carbonate de sodium : 2Ph-CHBr-CHBr-COOH + CO32- --> 2Ph-CH=CHBr + 2Br- + 3CO2 + H2O. (Ph désigne le groupe phényle C6H5) Durée approximative : 6 heures ; matières premières : acide dibromo-2,3 phényl-3 propanoïque : 30,8 g, carbonate de sodium 16 g, éther éthylique : 50 mL. Mode opératoire : Dans un réacteur de 250 mL équipé d'un agitateur et d'un thermomètre, d'une ampoule de coumée et d'un réfrigérant ascendant, introduire 30,8 g d'acide dibromo-2,3 phényl-3 propanoïque et une solution de 7,5 g de carbonate de sodium dans 60 mL d'eau. Chauffer doucement jusqu'à ce que la température atteigne 80°C. - Vérifier le dégagement de dioxyde de carbone. - Lorsque le dégagement cesse ajouter une solution constituée de 8,5 g de carbonate de sodium dans 20 mL d'eau. Maintenir à 80 °C pendant 15 min. - Equiper l'appareil pour une hydrodistillation et l'effectuer - Séparer la phase organique par décantation. Il peut être nécessaire d'ajouter du chlorure de sodium pour faciliter la séparation des deux phases.. - Epuiser la couche aqueuse par deux extractions avec chaque fois 25 mL d'éther diéithylique. - Sécher avec du sulfate de magnésium anhydre. Distiller l'éther à température ambiante, puis le ß-bromostyrène sous pression réduite. On propose une analyse du protocole pour l'adapter en vue de l'adopter pour les élèves du lycée général. Risques et consignes de
sécurité. Température de changement d'état,
solubilité dans différents solvants (
eau, eau salée, éther
éthylique), densité. acide dibromo-2,3 phényl-3 propanoïque : acide 2,3 dibromo-3-phénylpropanoïque ; ß-bromostyrène : 1-bromo-2-phényléthène ; éther diéithylique : éthoxyéthane ou 3-oxapentane. Que pensez-vous des quantités de réactifs proposées dans le protocole ? Comment les adapter au lycée général ? Ces quantités sont trop importantes ( coût élévé des réactifs, gestion des déchets) ; on peut les diviser par 4 ou 5. Prendre un réacteur de 100 mL. Le dégagement de dioxyde de carbone peut être vérifié par le trouble de l'eau de chaux : Comment modifier ce montage pour le mettre en évidence ? On adapte en haut du réfrigérant droit, un tube à dégagement ; ce dernier va barboter dans la solution d'eau de chaux. Que se passe t-il si le dioxyde de carbone barbote longtemps dans l'eau de chaux ? Le dioxyde de carbone, en présence d'eau de chaux Ca(OH)2 donne un solide CaCO3. Le dioxyde de carbone en barbotant longtemps, réagit avec l'eau, donne un acide : le pH va donc diminuer et on observe une redissolution du solide CaCO3 selon : CaCO3 (s) +CO2 (aq) + H2O = Ca2+ + 2HCO3-. Comment relier ce phénomène au danger d'une accumulation de dioxyde de carbone dans l'atmosphère et donc dans les océans ? Les océans absorbent une bonne partie du CO2 : le pH des eaux de surface, d'ici quelques dizaines d'années, va baisser. Le calcaire formant la coquille de certains coquillage sera attaqué. La disparition de ces coquillages aura des conséquences sur d'autres espèces qui s'en nourrissent ( disparition d'espèces). Pourquoi la séparation des deux phases est-elle meilleur en présence de chlorure de sodium ? Opération dite de "relargage" : les composés organiques sont moins solubles dans l'eau salée que dans l'eau. De plus la densité de la phase aqueuse augmente, la séparation par décantation est plus aisée.
Pour justifier les deux extractions successives, on peut raisonner sur un exemple : soit V0 le volume de phase aqueuse et V le volume de solvant organique utilisé pour chaque extraction. On appelle n0 la quantité initiale ( en moles) de composé A à extraire dans la phase aqueuse, n1 la quantité de A passant dans la phase organique à la première extraction, n2 la quantité de A passant dans la phase organique à la seconde extraction. La constante de partage est K= CS/CE, avec CS : concentration de A dans la phase organique et CE : concentration de A dans la phase aqueuse. Exprimer la fraction de A restant en solution aqueuse, soit ( n0-n1) / n0, en fonction de K, V0, V après la première extraction. CS = n1/V ; CE = ( n0-n1)/V0 ; K = CS/CE = n1 V0 / (( n0-n1) V ) ( n0-n1)K V = n1 V0 ; n1 (V0 +K V) =n0K V ; n1 = n0K V / (V0 +K V) ; n1 / n0 = K V / (V0 +K V) 1- n1 / n0 = V0 / (V0 +K V).
Si on réalise une chromatographie en phase gazeuse on observe deux pics très proches l'un de l'autre. Interpréter. Le 1-bromo-2-phényléthène possède deux diastéréoisomères Z et E. Proposer un mécanisme pour cette réaction. Réaction de type acide base : 2Ph-CHBr-CHBr-COOH + CO32- --> 2Ph-CHBr-CHBr-COO- +CO2 + H2O. Suivie de :
|
|||||||
|
|
|||||||
|
|