|
Le nickel de Raney : hydrogénation; diagramme E-pH de l'aluminium concours chimie Capes 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
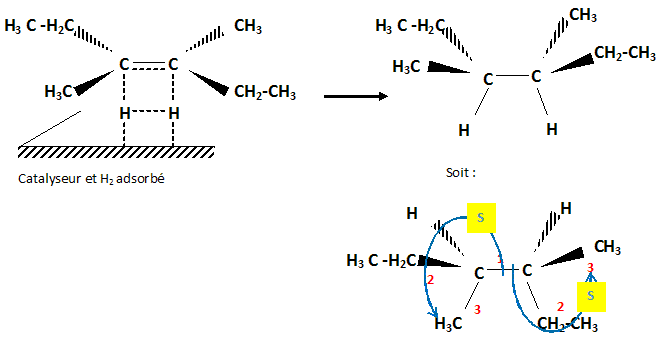
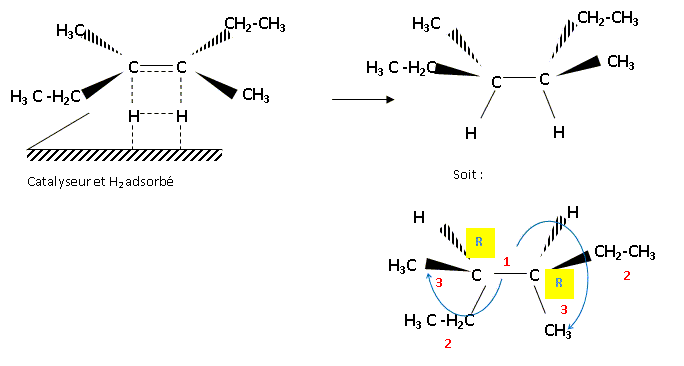
Stéréochimie de l'hydrogénation des alcènes sur le nickel de Raney. Donner la formule du ( ou des ) produits obtenu(s) lors de l'hydrogénation catalytique sur du nickel de Ranay du (E)- 3,4-diméthylhex-3-ène. Justifier en précisant le déroulement stéréochimique de l'hydrogénation des alcènes avec ce catalyseur. Préciser les descripteurs stéréochimiques ( configurations absolues ) des éventuels atomes de carbone asymétrique du ( des) produit(s) obtenu(s).
On obtient le mélange racémique. Quel est le produit
d'hydrogénation des alcynes avec le nickel
de Raney ? On obtient l'alcane correspondant en passant par
le stade alcène. Citer un catalyseur
permettant l'hydrogénation des alcynes en
alcènes et préciser sa
composition. Catalyseur de Lindlar : il est obtenu par
réduction du chlorure de palladium en
présence d'une boue de carbonate de calcium
; puis on le désactive par l'addition
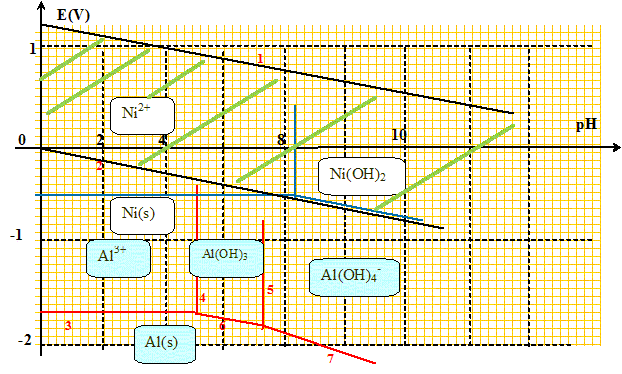
d'acétate de plomb. On donne à 298 K : - potentiel standard : E°(H+/H2)=0,00 V ; E°(O2/H2O)=1,230 V ; E°(Al3+/Al)=-1,66 V ; - produit de solubilité Ks(Al(OH)3 )= 10-32,0 ; - réaction de formation globale de [Al(OH)4]- : Al3+ + 4HO- = [Al(OH)4]- de constante ß4 =2 1033. Le nickel de Raney est préparé à partir d'un alliage aluminium/ nickel l : l en poudre. L'aluminium de cet alliage est dissout dans une solution concentrée ( jusqu'à 5 mol/L) d'hydroxyde de potassium ( potasse). Afin de justifier la méthode de préparation, on étudie le diagramme potentiel-pH de l'aluminium limité aux espèces Al(s), Al3+(aq), Al(OH)3(s) et [Al(OH)4]- (aq). Ce diagramme est supperposé à celui du nickel limité aux espèces Ni(s), Ni2+(aq) et Ni(OH)2(s). La concentration du tracé est c= 1,0 10-5 mol/L. Hachurer sur ce diagramme le domaine de stabilité de l'eau ; on prendra p(O2)=p(H2) = 1 bar.
Justifier le tracé en précisant les équations de toutes les frontières tracées. (1) : couple (O2/H2O) : ½ O2 + 2H+ + 2e- = H2O ; E1 = 1,23 + 0,03 log ([H+]2 p½O2 )= 1,23 - 0,06 pH. (2) : couple (H+/H2) : 2H+ + 2e- = H2 ; E2 = 0 + 0,03 log ([H+]2 / pH2 )= -0,06 pH. (3) : couple (Al3+/Al) : Al3++3e- =Al (s); E3 = -1,66 + 0,02log [Al3+] = -1,66 + 0,02 log 10-5 = -1,76 V. (4) : [Al3+] [HO-]3 = Ks(Al(OH)3 )= 10-32,0 ; [HO-]3 = 10-32,0 /10-5 = 10-27 ; [HO-] = 10-9 ; [H+] = 10-5 mol/L ; pH=5. (5) : frontière entre Al(OH)3 et [Al(OH)4]- : Al3+ + 4HO- = [Al(OH)4]- de constante ß4 =2 1033 = [Al(OH)4]- / ([Al3+][HO-]4) [Al3+] [HO-]3 = Ks(Al(OH)3 )= 10-32,0 d'où : ß4 Ks(Al(OH)3 ) = [Al(OH)4]- /[HO-] ; [HO-] = [Al(OH)4]- /(ß4 Ks(Al(OH)3 ) )= 10-5 / (2 1033*10-32,0)= 5 10-7 mol/L ; [H+] = 2 10-8 mol/L ; pH=7,7.
Retrouver l'équation de la frontière Al(OH)3(s) / Al(s). (6) Al3++3e- = Al (s) = E = -1,66 + 0,02log [Al3+] (Al(OH)3 =Al3++3HO- ; Ks(Al(OH)3 ) = [Al3+] [HO-]3 E6 = -1,66 + 0,02 log (Ks(Al(OH)3 ) / [HO-]3) = -1,66 + 0,02 log (Ks(Al(OH)3 ) /Ke3) + 0,02 log [H+]3. E6 = -1,66 +0,02 log( 10-32,0/ 10-42) - 0,06 pH = -1,46 - 0,06 pH.
|
|||||||
|
|
|||||||
|
|