|
Réaction de Diels Adler ; réaction de Wittig concours chimie Capes 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
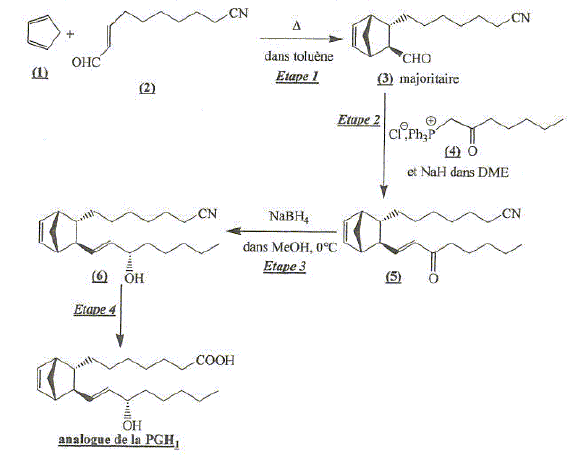
Etude de l'étape 1 : réaction de Diels-Alder. Donner le
mécanisme de cette
réaction. Le produit étant
gazeux, quelle est l'influence de la pression
à température constante ?
Justifier. A partir de 2 n moles de réactifs gazeux
on obtient au plus n mole d'un produit gazeux. Le nombre de moles d'espèces gazeuses
diminue : la réaction dans le sens direct
est favorisée par une augmentation de
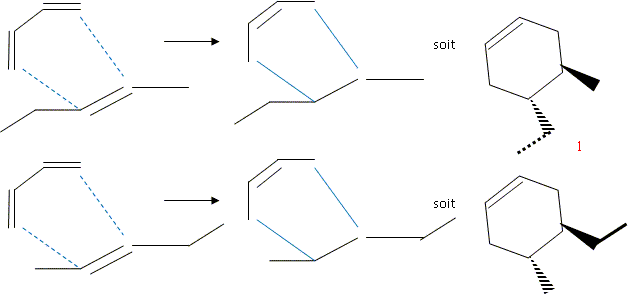
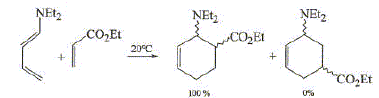
pression. Lorsque l'on fait réagir le buta-1,3-diène sur le (E)-pent-2-ène, on obtient un mélange racémique. Quels sont les produits obtenus ?
Quel(s) produit(s) obtient-on si on part du (Z)-pent-2-ène ?
Quelle relation de stéréoisomérie y a-t-il entre les produits obtenus aux questions précédentes ? Comment qualifie t-on ce type de réaction ? Diastéréoisomères 1 et 2. On conserve la
stéréochimie du diènophile. Les
réactions de Diels Adler sont
stéréospécifiques.
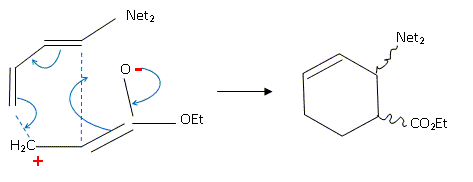
Même si ce n'est pas une réaction ioniqu, on peut, dans certains cas, prévoir la formation préférentielle d'un isomère en examinant les charges présentes dans la forme mésomère chargée la plus représentative du diène et de l'alcène. On veut justifier la régiosélectivité observée dans la réaction suivante ( on ne s'intéressera pas à la stéréochimie).
Quels sont les effets électroniques ( inductifs et mésomères) des groupements NET2 et -CO2Et ? L'atome d'azote a un effet inductif attracteur ; de même le l'oxygène doublement lié au carbone dans le groupe ester. Substituants à effet mésomere +M ( donneurs d'électrons p ou n) : NET2 Substituants à effet mésomere -M ( accepteurs d'électrons p ou n ) : -CO2Et Quel est pour chaque réactif la forme mésomère chargée la plus représentative ? Expliquer alors la régiosélectivité observée ?
Réaction de Wittig. La seconde étape de cette synthèse est une réaction de Wittig. Elle permet la préparation régiosélective d'alcènes par action de composés phosphorés sur les aldehydes ou les cétones. Etude de la triphénylphosphine. Le dérivé 4 est obtenu par une réaction de substitution nucléophile. Préciser les deux réactifs nécessaires à cette synthèse. 1- chloroheptan-2-one et triphénylphosphine. La triphénylphosphine est un
solide blac. L'étiquette comporte le pictogramme de
sécurité : Quel est le risque signalé par le pictogramme ? Nocif, irritant. Quelle est la signification des lettres R et S : R : phrases de risque ; S : phrases de sécurité. Quelles précautions doit-on respecter au cours de la manipulation de la triphénylphosphine ? Risques : nocif en cas d'ingestion ; peut entraîner une sensibilisation par contact avec la peau ; peut entraîner des effets néfastes à long terme pour l'environnement aquatique. Sécurité : eviter le contact avec la peau ; port de gants appropriés ; éviter le rejet dans l’environnement.
Donner l'équation bilan de la réaction. PCl3 + 3PhMgBr = PPh3 + 3 MgBrCl La triphénylphosphine obtenue peut être recristallisée soit dans l'éthanol chaud soit dans l'isopropanol chaud. Quels sont l'intérêt et le principe d'une recristallisation ? Purification de la triphénylphosphine. Le solide à purifier est dissout dans un solvant ou dans un mélange de plusieurs solvants chaud ; puis on refroidit la solution pour provoquer la cristallisation du solide que l’on isole par filtration. Quant aux impuretés, elles doivent êtres solubles dans le solvant à chaud comme à froid.
|
|||||||
|
|
|||||||
|
|
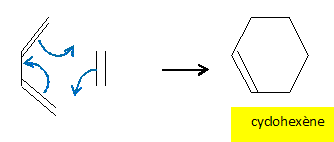
 Xn.
Xn.