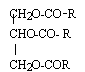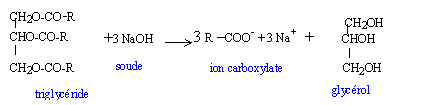|
Les savons, les triglycérides concours caplp interne 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||
| .
. |
|||||||||
|
|||||||||
|
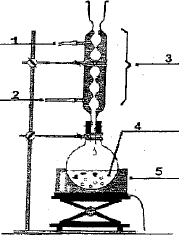
Etude d'une saponification. Dans un ballon de 250 mL, on introduit 5 mL de benzoate d'éthyle de formule brute C9H10O2 et 25 mL d'une solution d'hydroxyde de sodium à 4 mol/L. On aoute quelques grains de pieere ponce. On chauffe à reflux pendant 15 min. Après refroidissement du mélange,on ajoute un excès d'acide chlorhydrique ; un précipité d'acide benzoïque apparaît. Après filtration sous vide et séchage à l'tuve, il est pesé, on obtient 3 g d'acide benzoïque. Masse volumique du benzoate d'éthyle r=1050 kg m-3. Proposer un schéma légendé du montage à reflux.
On accélère la réaction qui est lente et on évite les pertes de matière, les vapeurs se condensent dans le réfrigérant et retombent dans le milieu réactionnel. La pierre ponce régularise l'ébullition lors du chauffage à reflux. Représenter la structure de Lewis de l'atome d'oxygène puis celle de l'ion hydroxyde. Cet ion présente t-il un site nucléophile ? électrophil ? Lequel. Dans l'ion hydroxyde l'atome d'oxygène, riche en électrons, est un site nucléophile (ami des noyaux).
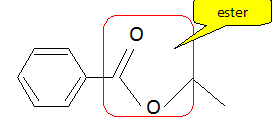
Donner la formule semi-développée du benzoate d'éthyle. A quelle famille chimique appartient-il ? Donner la formule de son groupe fonctionnel. Sur les atomes
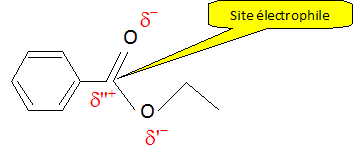
caractérisant le groupe fonctionnel du
enzoate d'éthyle, indiquer les charges
électriques partielles, puis en
déduire si le carbone du groupe fonctionnel
est un site électrophile ou
nucléophile.
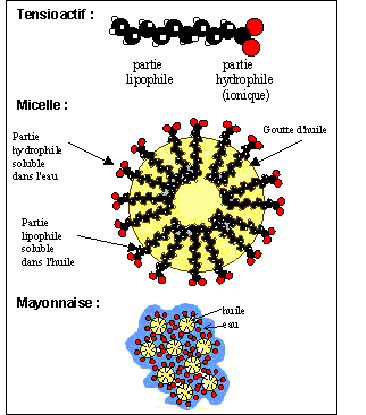
Donner les caractéristiques d'une réaction de saponification. Lente, totale. Expliquer comment un détergent tel que le savon élimine au cours du lavage les taches graisseuses.
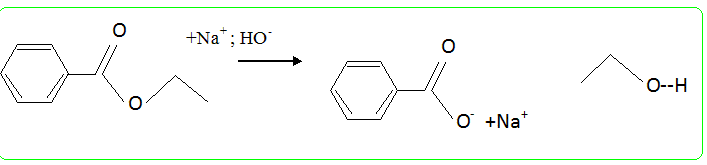
Ecrire l'équation bilan de la réaction qui se produit lors de l'ajout de la solution d'acide chlorhydrique. Calculer la constante d'équilibre de cette réaction. Conclure. C6H5COO- + H3O+ = C6H5COOH + H2O. K = [C6H5COOH] /( [C6H5COO-] [H3O+] ) = 1/Ka = 1 / 10-4,2 = 104,2 ; valeur importante, la raction est totale. Calculer le rendement de la saponification. Masse benzoate d'éthyle m = 5 *1,05 =5,25 g ; masse molaire M = 9*12+10+32=150 g/mol n=m/M =5,25 / 150=3,5 10-2 mol M(acide benzoïque) = 122 g/mol ; mthéorique = 3,5 10-2*122 = 4,3 g; rendement 3/4,3 ~ 0,7.
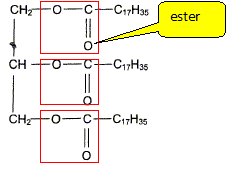
Les corps gras. Les corps gras ou triglycérides sont des triesters du propan-1, 2, 3-triol et d'acides carboxyliques aliphatiques linéaires à longues chaînes. Quand qualifie t-on un composé chimique d'aliphatique ? Absence de cycles entre les atomes de carbone de la chaîne carbonée. Donner le nom usuel du propan-1, 2 , 3 -triol et écrire sa formule semi-développée. glycérol HOCH2-CHOH-CH2OH. Ecrire la formule générale semi-développée d'un triglycéride. ( exemple de la stéarine)
Les corps gras peuvent être caractérisés par leur indice de saponification. L'indice de saponification d'un triglycéride correspond à la masse ( en mg) de potasse nécessaire pour saponifier 1 g de ce triglycéride. L'indice de saponification d'un triglycéride permet de déterminer sa masse molaire moléculaire. Pour déterminer l'indice de saponification d'un triglycéride homogène pur on utilise le protocol suivant : Prise d'essai : dans un erlenmeyer, on ontroduit mT = 2 g de triglycéride insaturé, 20 mL de solvant ( isobutanol éthanol) et 10 g d'une solution alcolique d'hydroxyde de potassium de concentration 0,5 mol/L. On chauffe à reflux pendant une heure. Une fois le mélange refroidi, on ajoute deux gouttes de phénolphtaléine, puis on dose à l'aide d'une solution d'acide chlorhydrique de concentration ca =0,5 mol/L, la décoloration est obtenue pour un volume VE1 = 5,00 mL d'acide versé. Prise témoin :on opère de façon identique à la prise d'essai mais sans ajouter de triglycéride. La décoloration est obtenue pour un volume VE2 = 18,80 mL d'acide versé.
|
|||||||||
|
|
|||||||||
|
|