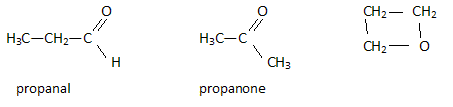|
Préparateur en chimie : concours ITRF Poitiers 2008.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
K : 39,1 ; H : 1,0 ; Mn : 54,9 ; Na : 23,0 ; O : 16,0 ; Mg : 24,3 Donner la formule brute du permanganate de potassium et calculer sa masse molaire : KMnO4 ; M = 39,1 + 54,9 + 4*16 = 158 g/mol. Quelle quantité doit-on peser pour préparer 500 mL de solution à 0,5 mol/L ? Quantité de matière (mol) = concentration (mol/L) * volume de la solution ( L) n = C V = 0,5*0,5 = 0,25 mol. Masse (g) = quantité de matière (mol) * masse molaire ( g/mol) = 0,25*158 = 39,5 g. A partir de cette solution mère, on réalise une dilution pour obtenir une solution à 10 mmol/L. Quel volume de solution mère doit-on prélever pour un volume final de 100 mL ? 10 mmol/L = 0,01 mol/L ; facteur de dilution : F = concentration mère / concentration fille = 0,5/0,01 = 50. Volume de solution mère à prélever : volume final / F = 100 / 50 = 2 mL. Pour l'ensemble de cette préparation, vous disposez du matériel suivant : pipette jaugée, pipette graduée, burette, propipette, becher, fiole jaugée, éprouvette, ballon rodé. Lequel choisir ? La solution mère est dans un bécher ; la solution mère est prélevée à l'aide d'une pipette jaugée + propipette. La solution fille est dans une fiole jaugée de 100 mL. NaOH ; MM=40 ; solution
à 32 % ; d=1,35. Qèuel volume de
solution commerciale d'hydroxyde de sodium
devez-vous prélever pour préparer 1 L
d'une solution diluée à 0,5
mol/L ? Un litre de solution commerciale a une masse de
1,35 kg ( 1350 g). Masse d'hydroxyde de sodium pur dans 1 L de
solution commerciale : 1,35*0,32 = 0,432 kg = 432
g Quantité de matière (mol) = masse
(g) / masse molaire (g/mol) = 432/40 =120,8 mol Concentration de la solution mère : 10,8
mol/L. Facteur de dilution F = concentration
mère / concentration fille ( sol
diluée) = 10,8/0,5 = 21,6. Volume à prélever : volume final /
F = 1 /21,6 =0,0463 L =
46,3
mL.
MnO4- + 8 H+ +5 e- = Mn2+ + 4 H2O. 2 NaOH + H2SO4 = Na2SO4 + 2 H2O. C4H10 + 13,5 O2 = 4 CO2 + 5 H2O. CaCO3 + 2 HCl = CO2(g) + CaCl2 + H2O. Nommer les fonctions suivantes.
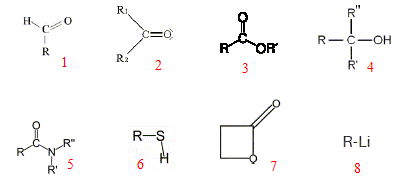
1 : aldehyde ; 2 : cétone ; 3 : ester ; 4 : alcool tertiaire ; 5 : amide ; 6 : thiol ; 7 : lactone ; 8 : organolithien.
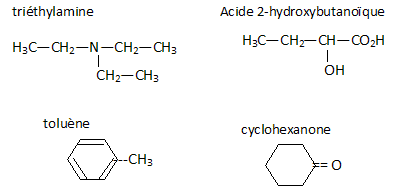
Donner les formules semi-développées des produits suivants :
L'analyse élémentaire d'un produit organique donne C3H6O. C : 12,01 ; H :1,01 ; O : 15,99 g/mol. Déterminer la masse molaire. M = 3*12,01 + 6*1,01 + 15,99 =58,08 g/mol. Déterminer la composition centésimale en masse de ce composé. Proportion de carbone C : 3*12,01 / 58,08 *100 =62,04 %. Proportion d'élément hydrogène : 6*1,01 / 58,08 *100 =10,43 %. Proportion d'élément oxygène : 15,99 / 58,08 *100 =27,53 %. Donner la représentation de trois isomères possibles.
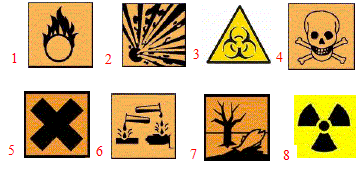
Quel code de couleur est associé aux gaz suivants.
trompe à eau ; pompe à membrane ; pompe à diffusion. 10-3 mbar = 10-3 hpa. Le vide prrimaire ( 1000 à 1 hPa) est obtenu à l'aide de pompe à palettes. Le vide secondaire ( 1 à 10-7 hPa) est obtenu à l'aide de pompe turbomoléculaire, de pompe à diffusion d’huile. Quelle est la plage d'unité de pH d'utilisation d'une électrode combinée ? 0 à 7 ; 7 à 14 ; 0 à 14. Quelle solution utilisez-vous pour un stockage prolongé de cette dernière ? KCl à 3 mol/L. Faire l'association entre techniques et matériel.
- l'acétone de lavage ( non ); une solution aqueuse de chlorure de potassium ( oui ) ; du toluène ( non ) ; une solution acide diluée ( 10-3 mol/L ( oui ) ; une solution de sel de chrome ( non ). Pour diluer un acide concentré on procède en versant l'eau dans l'acide : non, verser l'acide concentré dans l'eau.
Peut-on stocker dans la même armoire ? - éther de pétrole et chloroforme non solvant inflammable et solvant chloré - solution de soude et du sodium non le sodium doit être maintenu en absence d'humidité - acide nitrique et potasse : non réaction acide base exothermique - peroxyde d'hydrogène et aluminium : non réaction oxydoréduction exothermique - acide oxalique et acide chlorhydrique oui. Citez quatre équipements collectifs de sécurité disponibles dans une salle de TP de chimie. Extincteurs, douche, couverture, ventilation des salles. Equipements de Protection Individuelle : blouse, gants, lunettes et chaussures de sécurité.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|