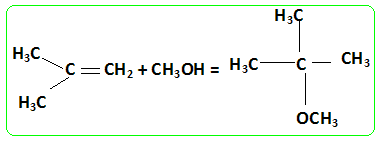|
utilisation des bioalcools, pile à combustible au méthanol chimie concours Mines 08
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
On peut utiliser les bioalcools soit comme carburant pur moyennant une transformation du moteur, soit comme additifs à l’essence. Dans ce dernier cas, on peut les additionner tels quels jusqu’à 10% ou les transformer en éthers. Le MTBE et l’ETBE sont les composés oxygénés les plus utilisés à ce jour. Le MTBE (méthylter-tiobutyléther) peut être synthétisé à partir de 2-méthylpropan-2-olate de sodium et d’iodure de méthyle. Écrire les formules semi-développées des deux réactifs dans la synthèse du MTBE. Écrire l’équation de la réaction qui se produit et en déduire la formule du MTBE. Réaction de Williamson ; un mécanisme de type SN2 est plus probable que la substitution SN1 : le carbocation primaire CH3+ est peu stable et le carbone de CH3I est très peu encombré. D'autre part l'alcoolate est un nucléophile très fort. Proposer une méthode de synthèse de l’alcoolate. Quel type de solvant doit-on utiliser pour la réaction ci-dessus et pourquoi ? On obtient un alcoolate en faisant réagir du sodium sur un alcool : ROH + Na = RO- + Na+ +½H2(g). Il ne faut pas que le solvant puisse réagir avec l'alcoolate : le solvant doit être aprotique. Écrire
l’équation de la
réaction.
H+ facilite la réaction ( assistance électrophile à la première étape), puis H+ est régénéré en fin de réaction. H+ n'apparaît pas dans le bilan. Proposer une raison pour laquelle la réaction précédente (1) n’est pas utilisée dans l’industrie. Le sodium est un métal inflammable à l'air ; la réaction du sodium avec l'eau est violente. Piles à combustible à méthanol. Des piles à combustible sont développées actuellement à partir de méthanol, nous étudierons celle à méthanol direct dans laquelle le méthanol est utilisé tel quel en tant que réducteur, l’oxydant étant du dioxygène. Ces piles ne sont pas très puissantes mais elles ont de grandes autonomies et peuvent être utilisées dans des appareils portables (microordinateurs, téléphones ou autres). Elles fonctionnent à des températures relativement basses autour de 70 °C. Le biométhanol est obtenu à partir de la biomasse lignocellulosique en deux étapes : conversion en gaz de synthèse (mélange de CO et H2) puis recombinaison en méthanol CH3OH. Les électrodes sont en graphite, métal ou en matériaux composites. La membrane séparant les deux compartiments est une membrane échangeuse d’ions. Écrire la demi-équation électronique correspondant à la demi-pile contenant le méthanol et en déduire l’expression du potentiel de Nernst E1 correspondant. Potentiels standard des couples (à 298 K) E1° (CO2/CH3OH) = 0, 02 V ; E2° (O2/H2O) = 1,23 V. CH3OH +H2O = CO2(g) + 6H+ + 6e- ; E1=E1° + 0,01 log ( PCO2 [H+]6/([CH3OH][H2O])) avec [CH3OH] = xCH3OH ; [H2O] =xH2O E1=E1° + 0,01 log ( PCO2 [H+]6/(xCH3OHxH2O) Remarque : l’eau et le méthanol étant en quantités proches, leurs activités sont égales à leurs fractions molaires.
Écrire la demi-équation électronique correspondant à la demi-pile contenant le dioxygène et en déduire l’expression du potentiel de Nernst E2 correspondant. Remarque : l’eau étant ici le seul liquide, son activité est prise égale à 1. O2(g) +4H+ + 4e- = 2H2O. E2=E2° + 0,015 log (PO2 [H+]4) Le courant circule dans le circuit, à l’extérieur de la pile, en partant de la demi-pile 2 vers la demi-pile 1. En déduire les polarités attendues de la pile et exprimer sa force électromotrice. La demi-pile 2 est la borne positive. E = E2-E1 = E2° - E1° + 0,06/4 log (PO2 [H+]4) -0,06/6 log ( PCO2 [H+]6/(xCH3OHxH2O)) E = E2° - E1° + 0,06/12 log (P3O2 [H+]12) -0,06/12 log ( P2CO2 [H+]12/(x2CH3OH x2H2O)) E = E2° - E1° + 0,06/12 log (P3O2(x2CH3OH x2H2O )/P2CO2 ).
|
|||||||
|
|
|||||||
|
|
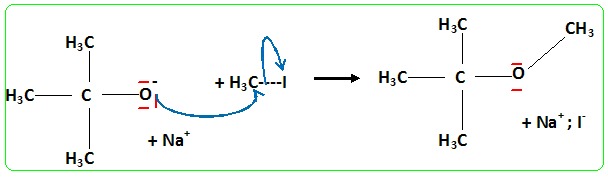 (1)
(1)